2019年8月29日,由上海科技大学免疫化学研究所特聘教授饶子和院士率领的科研团队与上海科技大学生命科学与技术学院特聘教授、中科院生物物理研究所胡俊杰研究员课题组合作,在《Nature Communications》上发表题为“Mycobacterial dynamin-like protein IniA mediates membrane fission”的研究论文。他们率先解析了一线抗结核药物――异烟肼诱导蛋白IniA的apo状态以及GTP结合态的三维空间结构,发现其具有类似细菌动力蛋白的折叠方式,并发挥膜分裂的功能,最终揭开了IniA 蛋白参与药物耐受的新机制,对解决结核病耐药性问题具有重要指导意义。
结核病是由结核分枝杆菌感染引发的一种致命性传染病。人类与结核病抗争的历史已逾150多年。自从上个世纪中叶链霉素、吡嗪酰胺、异烟肼、乙胺丁醇、利福平等有效药物被发现并用于治疗结核病以来,这个严重威胁人类生命健康的传染病才得以控制。然而全世界目前仍有约1/3的人口被结核杆菌感染,每年新发和死亡人数十分庞大。更为严重的是,在近半个世纪的药物使用以及漫长的个体治疗周期中,已经产生了各种耐药性结核病,其中相当一部分病例难以治愈。因此,耐药性问题显得尤为紧迫,急需找到应对之策。
IniA蛋白是分枝杆菌中能被异烟肼诱导的重要蛋白,与异烟肼、乙胺丁醇等抗结核药物的耐药性相关,而对它的结构、功能以及参与药物耐受机理方面一直都是空白。在该研究中,团队成员利用X射线晶体学手段成功解析了耻垢分枝杆菌IniA蛋白的apo状态(3.2Å分辨率)和GTP结合状态复合物(2.2Å分辨率)的三维空间结构。首次发现IniA 蛋白折叠属于dynamin超家族中的细菌动力蛋白家族。IniA具有一个经典的GTPase结构域以及两段螺旋束结构域Neck和Trunk。Neck和Trunk呈“V”形排布,这与cynobacteria的BDLP蛋白的溶液游离态形式类似。但是在Trunk的末端存在一段特殊的柔性lipid-interacting (LI) loop,体外脂质体漂浮实验和细胞荧光定位实验表明LI loop可以与带负电荷脂类相互作用从而插到细胞膜上。研究发现,与其他dynamin不同,IniA在溶液中并不形成核苷酸依赖性的二体形式,而Lipid tethering实验表明IniA可以在膜上形成核苷酸非依赖性的聚合现象。进一步的Giant unilamellar vesicles(GUVs)实验和Supported membrane tubes (SMrTs)切割实验证明IniA具有改变膜形态的能力并行使GTP水解依赖性的膜分裂功能。细菌动力蛋白家族的分子活性长期以来有较大争论,由于在构架和进化上接近线粒体融合素(Mitofusin, MFN),这类蛋白一直被认为可以介导膜融合,而这项工作清楚的阐明细菌动力蛋白具有膜分裂而不是膜融合的能力。
虽然在对细菌动力蛋白的解析方面有较多进展,但其生理功能也一直困扰着研究人员。IniA的突变体药物耐受实验最终揭示了IniA通过介导膜结合和膜分裂引起药物耐受。由于异烟肼、乙胺丁醇会抑制结核杆菌细胞壁合成,因而细胞膜缺乏保护而变得不稳定、易损伤。IniA可能通过膜分裂的方式参与了膜损伤的修复,从而维持了细胞膜的完整性,增加了病原菌在药物压力下的存活能力。这些发现首次揭开了IniA 蛋白的神秘面纱,为解决结核病耐药性问题提供了新的线索。
饶子和院士团队长期致力于我国新发、再发传染性疾病病原体的结构生物学研究,这是该团队在抗结核领域取得的又一重要研究成果。上海科技大学饶子和院士的博士研究生王满福和南开大学胡俊杰教授的博士毕业生郭向阳为本文的共同第一作者,上海科技大学免疫化学研究所饶子和院士团队骨干成员李俊副研究员、生物物理所胡俊杰研究员为本文的共同通讯作者。同时,我校免疫化学研究所杨秀娜副研究员、张兵副研究员也参与了此项研究。上海科技大学为第一完成单位。该研究得到了科技部先导项目、重点研发计划、973计划、国家自然科学基金和中科院基金项目的大力支持。
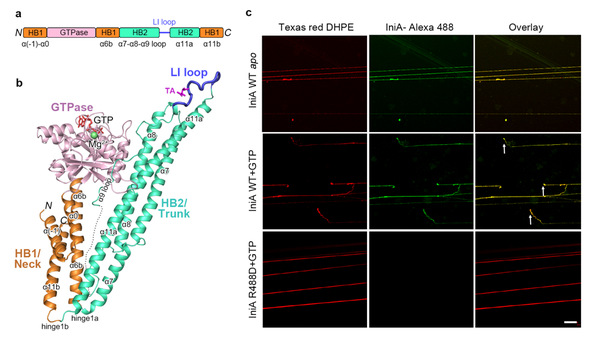
Figure 1. (a)IniA结构域分布;(b)IniA整体结构;(c)SMrTs fission实验
论文链接:https://www.nature.com/articles/s41467-019-11860-z



