近日,我校免疫化学研究所抗体结构实验室Co-PI杨贝与中国科学院分子植物科学卓越创新中心研究员张余、赵国屏院士及浙江大学教授冯钰通力合作,通过交叉运用单颗粒冷冻电镜、氢氘交换质谱等多种技术手段,揭示了一种特殊的、不依赖于转录激活因子与DNA之间相互作用的转录激活分子机制。目前该研究成果以“Crl activates transcription by stabilizing active conformation of the master stress transcription initiation factor”为题在线发表于eLife杂志。
转录调控是细菌应对环境胁迫和病原菌缓解抗生素压力的重要手段,由细菌的转录核心机器RNA聚合酶和一系列转录起始sigma因子共同完成。在通常情况下,细菌的看家sigma因子(如大肠杆菌的sigma70)负责大多数的基因表达,而在环境胁迫下,sigmaS则快速占据主导,并通过开启特定基因的表达来帮助细菌适应不利环境。与细菌的看家sigma因子相比,sigmaS的活性通常较低,其功能的发挥通常需要转录激活因子的协助,而Crl正是一种sigmaS特异的转录激活因子。
此前,对于Crl激活转录的分子机制不甚清楚。在该研究中,合作者首先解析了E. coli Crl转录激活复合物的3.8 Å的冷冻电镜结构,该复合物包括了E. coli的RNA聚合酶、转录起始因子sigmaS、Crl、以及启动子DNA。在该结构中,Crl主要与sigmaS的domain 2相互作用,同时也与RNA聚合酶的最大亚基beta’有少许相互作用。与绝大多数传统的转录激活因子不同,电镜结构显示Crl并不结合启动子DNA,因此单从结构本身较难完全解释Crl对于sigmaS-RNAP的转录促进活性。在此基础上,上科大免化所团队进一步利用氢氘交换质谱(HDX-MS)对该系统进行了深入研究。氢氘交换质谱的结果揭示,Crl不仅直接结合sigmaS 的alpha2-alpha3螺旋(Figure 1A),还能够通过变构调节作用稳定sigmaS的 alpha4、alpha5等多个结构单元(Figure 1A-C),而这些结构单元的稳定将能够促进sigmaS与DNA以及sigmaS与RNA聚合酶之间的相互作用(Figure 1D)。基于以上数据,研究人员提出Crl通过特异性结合转录起始因子sigmaS,稳定sigmaS的活性构象,从而促进sigmaS与RNA聚合酶以及启动子DNA的结合组装,进而激活sigmaS-RNAP介导的转录。这一机制在后续的功能实验中得到了进一步验证。该工作呈现了一种新的转录因子与RNA聚合酶的结合方式,揭示了一种新的细菌转录激活分子机制。
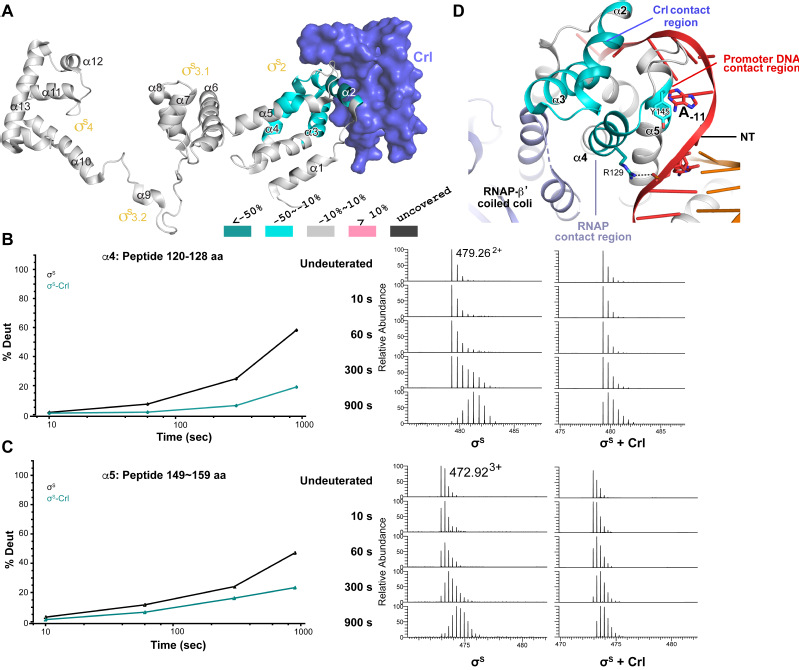
Figure 1. Crl promotes assembly of igmaS-RNAP holoenzyme by stabilizing sigmaS.
(A) HDX changes for sigmaSin the presence of Crl as compared to free sigmaS, mapped onto the cryo-EM structure of sigmaS. Protection from HDX exchange were observed for multiple peptides from alpha2-alpha5 of sigmaS (colored in cyan). For heatmap color coding, pink, cyan, and gray indicates increase, decrease, and no significant changes of HDX, respectively. Dark grey represents regions that were not consistently resolved in all HDX experiment.
(B-C) Deuterium uptake plots and mass spectra of indicated peptides from helices alpha4 (B) and alpha5 (C) in the absence and presence of Crl. Left: The deuterium uptake data are plotted as percent deuterium uptake versus time on a logarithmic scale. Right: Mass spectra of indicated peptides at different labeling time points, with the mass spectra of undeuterated samples shown as controls.
(D) A highlight of the sS regions with reduced HDX rate upon Crl binding, the colors are as in (A). Note that alpha4 and alpha5 of sigmaS makes contact with RNAP-beta’ subunit and promoter DNA respectively.
中国科学院分子植物卓越中心徐君操博士和上海科技大学硕士研究生崔恺婕为论文的共同第一作者,中国科学院分子植物卓越中心研究员张余及赵国屏院士、上海科技大学免疫化学研究所Co-PI杨贝和浙江大学医学院教授冯钰为论文的共同通讯作者。

杨贝,副研究员
免疫化学研究所抗体结构学实验室Co-PI
论文网址:https://elifesciences.org/articles/50928



