近日,上海科技大学免疫化学研究所杨贝/Ian A. Wilson研究团队通过交叉运用多种不同的技术手段,发现了肠道病毒属病毒重要药靶3C蛋白上两个不同于其蛋白酶活性中心的全新可靶向位点,同时,该工作首次证明了3C蛋白调控肠道病毒基因组复制的能力是独立于其蛋白酶活性之外的又一可靶向功能,为后续抗肠道病毒属病毒的药物研发工作提供了新思路。5月28日,该研究成果以“Inhibitory antibodies identify unique sites of therapeutic vulnerability in rhinovirus and other Enteroviruses”为题在线发表于《美国科学院院刊》(Proceedings of the National Academy of Sciences,PNAS)上。
小核糖核酸病毒科(Picornaviridae)的肠道病毒属(Enterovirus,EV)包括了脊髓灰质炎病毒、柯萨奇病毒、肠道病毒和鼻病毒等多种重要病原体。其中,由鼻病毒感染引起的感冒占人类感冒总发病率的50%~70%左右,且具有庞大的感染基数和季节复发性;此外,鼻病毒感染也是急性中耳炎、鼻窦炎和哮喘的主要病因之一,更是加剧慢性阻塞性肺病(COPD)恶化的重要因素。而由脊髓灰质炎病毒感染所引发的致残率在1/200左右,严重时甚至可能引起患者的呼吸骤停而导致死亡;柯萨奇病毒、肠道病毒等则是无菌性脑膜炎和手足口病(HFMD)的主要病因,也是I型糖尿病病因之一。肠道病毒属病毒引发的感染每年都给社会带来巨大的健康威胁和经济负担。然而对于这些病毒感染的防治,目前仅开发出针对肠道病毒A71和脊髓灰质炎病毒的疫苗。对于该病毒属的其他病毒来说,由于多种不同血清型(serotypes)的存在,相应的疫苗研发十分困难。因此,针对在不同病毒中均相对保守且发挥重要功能的关键蛋白来研发广谱、高效的抑制剂是控制肠道病毒属病毒感染的重要研发方向之一。
3C蛋白是由病毒基因组编码的蛋白酶,在肠道病毒属病毒间具有较高的序列保守性。它一方面负责切割病毒的多蛋白前体从而产生有功能的结构性(如衣壳蛋白)和非结构性病毒蛋白(如病毒编码的RNA聚合酶等),以用于后续的病毒基因组复制合成和新病毒组装,另一方面又通过切割与转录复制和免疫信号传导相关的宿主蛋白来达到劫持宿主的转录、翻译系统及抑制宿主抗病毒反应的目的。由于其在肠道病毒属病毒生命周期中的关键作用,3C蛋白一直是抗病毒药物研发的焦点。自上世纪90年代以来,针对3C蛋白的酶活性中心已有大量的药物研发尝试。然而,3C蛋白酶活性中心的亲核性质使得靶向该位点的小分子抑制剂均带有高反应性的亲电基团,由此引发的脱靶效应和不良药代动力学特征等问题使得这些小分子抑制剂难以在临床试验中推进。在此背景下,探寻3C蛋白上新的可靶向位点并针对这些位点进行相应的药物研发就显得尤为迫切和重要。
在此前的研究中,上科大免化所特聘教授Richard A. Lerner博士在美国Scripps研究所的研究团队通过细胞内组合抗体库结合表型筛选的方式鉴定出两个命名为YDF和GGVV的单链抗体,它们在Hela细胞体系中对鼻病毒的感染表现出显著的抑制作用(Xie, J. et al., 2014, Chem Biol. 21:274-83)。然而,这两株单链抗体抑制鼻病毒感染的具体机制却并不明确。针对这一现象,在本研究中,上科大免化所杨贝/Ian A.Wilson研究团队交叉运用多种不同的技术手段对这两株抗体的病毒抑制分子机理开展了研究。研究结果显示,YDF和GGVV均可与鼻病毒的3C蛋白结合并形成稳定的复合物。但出乎意料的是,二者与3C蛋白的结合位点都独立于后者已知的酶活性中心(图1),提示它们可能通过全新的分子机制来发挥独特的病毒增殖抑制效应。
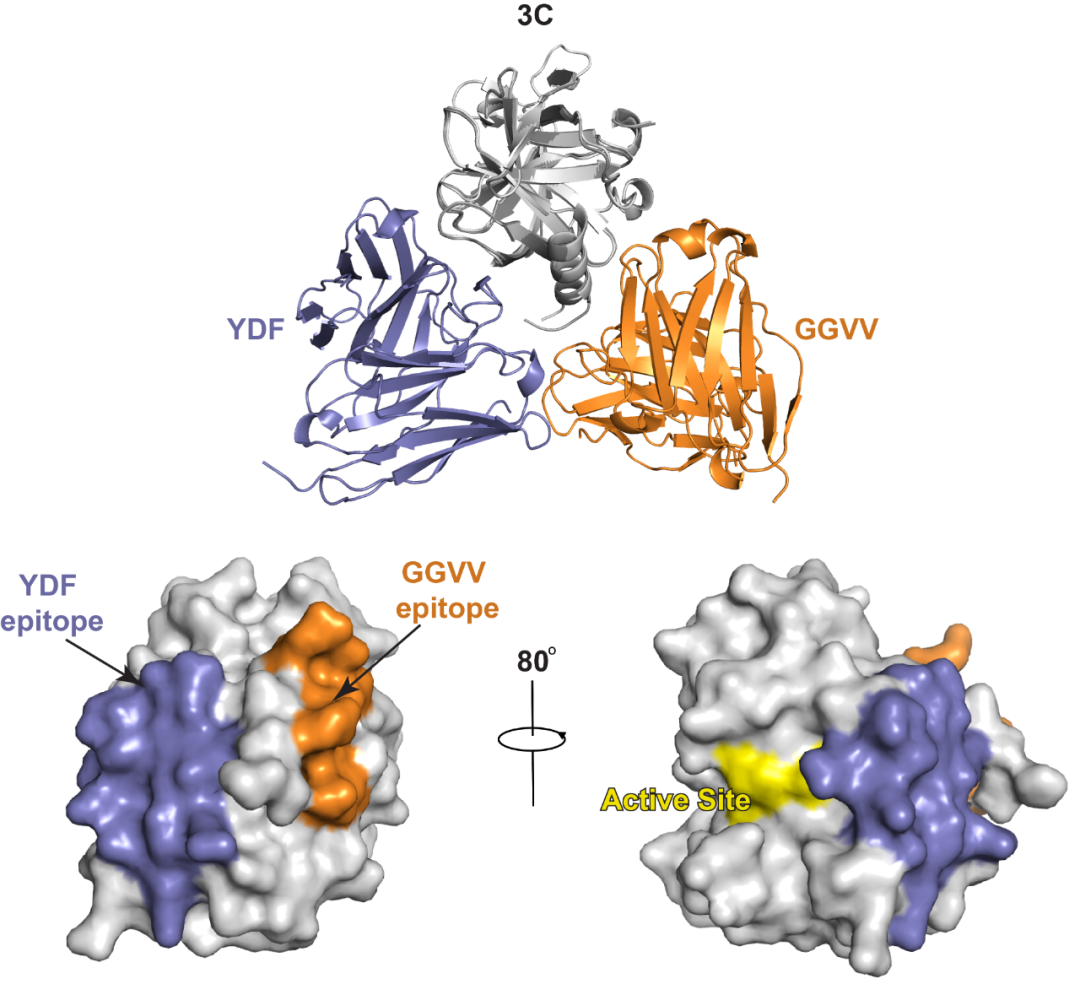
图1、YDF及GGVV分别结合于3C蛋白上非酶活性中心的不同抗原表位。图中上方为3C与YDF抗体复合物及3C与GGVV抗体复合物的叠加结构图,其中3C蛋白表示为灰色,单链抗体YDF表示为紫色,单链抗体GGVV表示为橘黄色。图中下方为在3C蛋白的表面结构图上(灰色)用紫色和橘黄色突出显示单链抗体YDF和GGVV的结合区域,鼻病毒 3C蛋白的活性位点则显示为黄色表面。
在后续的研究中,研究团队通过进一步的酶动力学实验和分子动力学模拟发现,单链抗体YDF可以作为 3C蛋白的非竞争性抑制剂对后者的蛋白酶活性发挥别构抑制作用(图2)。这一发现不仅揭示了YDF抑制鼻病毒感染的具体分子机理,同时也发掘了3C蛋白上一个此前从未被报道过的酶活别构调节位点(即YDF抗原表位)。
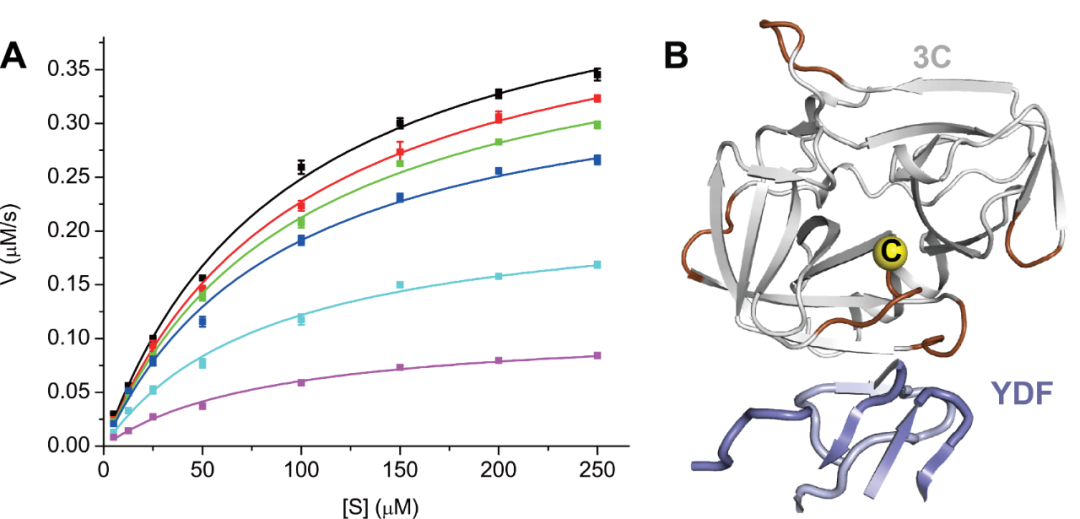
图2、YDF通过别构效应非竞争性地抑制3C的蛋白酶活性。(A)在不同摩尔比的YDF存在情况下测定3C的蛋白酶活性,YDF摩尔比的增加仅降低Vm,而不影响KM。(B)分子动力学模拟的结果表明,YDF的结合会通过别构效应显著降低酶活性中心关键氨基酸的活动性,图中棕色区域的活动性(RMSF)在YDF结合后表现出明显下降,关键氨基酸(Cys, C)以黄色球型显示。
同时,研究团队也对单链抗体片段GGVV抑制人鼻病毒感染的具体分子机理开展了深入研究。研究结果表明GGVV对3C的蛋白酶活性没有任何影响,而是通过阻断3C蛋白与病毒基因组5’非编码区之间的相互作用来拮抗3C蛋白在病毒基因组复制中的调控功能(图3),从而抑制人鼻病毒的感染与增殖。这一发现不仅第一次揭示了3C蛋白对病毒基因组复制的调控是独立于其蛋白酶活性的另一个可靶向功能,同时也发掘了3C蛋白上另一个全新的可靶向位点(GGVV抗原表位),从而为靶向3C蛋白的抑制剂药物研发提供了崭新的思路。值得注意的是,该可靶向位点在肠道病毒属的多种病毒间均具有高度的序列和结构保守性,有望成为抗肠道病毒属病毒的广谱药物研发的重要靶点。

图3、单链抗体GGVV通过靶向抑制3C蛋白与病毒基因组5’NCR之间的相互作用来拮抗3C蛋白在病毒基因组复制中的调控功能。(A)氢氘交换质谱(HDX-MS)结果显示3C蛋白和病毒基因组RNA的互作区域与GGVV的抗原表位部分重叠。图中青色区域的氢氘交换速率(HDX rate)在RNA结合后发生大幅下降,提示这部分区域位于蛋白与病毒基因组RNA的互作表面。(B)GGVV的结合阻断了3C蛋白和病毒基因组5’NCR片段(RNA片段)之间的相互作用,而YDF的结合则对二者的结合无影响。
上科大免化所博士后蒙冰为本工作的第一作者,上科大免化所Co-PI杨贝和美国Scripps 研究所教授兼上科大免化所特聘教授Ian A. Wilson院士为共同通讯作者,上科大为第一完成单位。本研究工作同时得到了美国Scripps 研究所教授兼上科大免化所特聘教授Richard A. Lerner院士研究团队的大力支持与帮助。国家蛋白质中心,上海同步辐射光源以及上科大免化所、iHuman研究所、生命学院的多个技术平台也为该课题的顺利开展提供了重要的仪器支撑和技术支持。
文章链接: https://doi.org/10.1073/pnas.1918844117



