2023年12月16日,上海科技大学免疫化学研究所免疫化学生物学课题组联合临港实验室谢成英课题组在国际学术期刊Experimental Hematology & Oncology上发表题为“Targeting ST8SIA6-AS1 counteracts KRASG12Cinhibitor resistance through abolishing the reciprocal activation of PLK1/c-Myc signaling”的研究论文。该研究报道了针对KRAS突变肿瘤治疗的新型耐药机制,提出了克服耐药的新策略。

Kirsten鼠类肉瘤病毒癌基因(KRAS)是人类恶性肿瘤中突变率最高的致癌基因之一,大约30%的高死亡率肿瘤与KRAS基因突变有关。由于KRAS缺乏典型的药物结合位点,直接靶向治疗极具挑战。近年来,KRASG12C特异性抑制剂研究取得重大突破,索托拉西布(sotorasib)和阿达格拉西布(adagrasib)相继上市,表现出较显著的疗效,为KRAS突变驱动的恶性肿瘤患者带来了希望。然而,临床数据显示,KRASG12C抑制剂在不同组织来源肿瘤中疗效不一,部分患者即使发生G12C突变,仍对抑制剂不敏感,表现为原发耐药,另一部分患者使用KRAS抑制剂后很快产生获得性耐药。目前临床上尚没有明确的敏感性生物标志物来预测患者对KRASG12C抑制剂治疗的反应,无法实现精准治疗。因此,寻找KRASG12C抑制剂原发耐药和获得性耐药的共性特征和克服策略具有极大的研究意义,这将为当前靶向治疗的耐药机制提供新的见解,并有助于指导新药研发工作。
本研究首先构建了KRASG12C抑制剂(KRASG12Ci)获得性耐药细胞株,并将其与亲本株进行体外的全基因组测序和比对,以寻找与耐药相关的关键基因和信号通路。研究者通过RNA-seq分析、功能增益和丧失、RNA/蛋白质相互作用和基因转录调控等实验,发现耐药株中MYC靶基因异常激活,调控细胞G2/M期的关键蛋白Polo样激酶1(PLK1)显著上调,并进一步阐明LncRNA ST8SIA6-AS1/PLK1/c-Myc这一信号调控通路及其高度活化导致KRASG12Ci原发和获得性耐药的分子机制。并且,在裸小鼠移植瘤模型中,联合KRASG12Ci与PLK1抑制剂(PLK1i)或ST8SIA6-AS1 siRNAs强效抑制KRASG12C突变肿瘤的生长并克服耐药。该工作融合了分子生物学、细胞生物学、生物化学以及生物信息学等多学科交叉技术手段,通过体内外疗效验证,为临床解决KRASG12Ci耐药问题提供可能的克服策略,并获得KRASG12Ci潜在的敏感性标志物。
具体而言,本研究深入揭示KRASG12Ci耐药细胞中调控ERK非依赖的c-Myc稳定性的新机制。研究发现,KRASG12Ci能显著且持续降低敏感细胞株中c-Myc的表达,但在ERK活性抑制程度相似的情况下对耐药株细胞的c-Myc影响不显著。LncRNA ST8SIA6-AS1可以与丝/苏氨酸激酶Aurora A和PLK1直接结合,促进Aurora A介导的PLK1磷酸化。PLK1增强c-Myc S62位点磷酸化和蛋白稳定性,上调的c-Myc作为转录因子继而直接识别启动子反应元件,诱导PLK1基因转录,形成一个正反馈回路。LncRNA ST8SIA6-AS1,PLK1和c-Myc对KRAS突变肿瘤的生长至关重要,且他们的高表达或高活化被证明是驱动细胞对KRASG12Ci产生耐药性的关键因素之一。
综上所述,本研究首次提出靶向LncRNA ST8SIA6-AS1/PLK1/c-Myc调控轴以提高肿瘤对KRASG12Ci敏感性并克服耐药的联合疗法。同时,研究表明ST8SIA6-AS1和c-Myc的丰度可能成为临床上评估KRASG12Ci敏感性和疗效的标志物。基于RNA疗法在抗肿瘤治疗中的潜力,以及目前KRASG12Ci和PLK1i已经上市或处于临床试验阶段的研发现状,联合抑制KRAS与ST8SIA6-AS1或PLK1对于KRASG12Ci耐药患者可能是一种前景广阔的新型治疗策略。
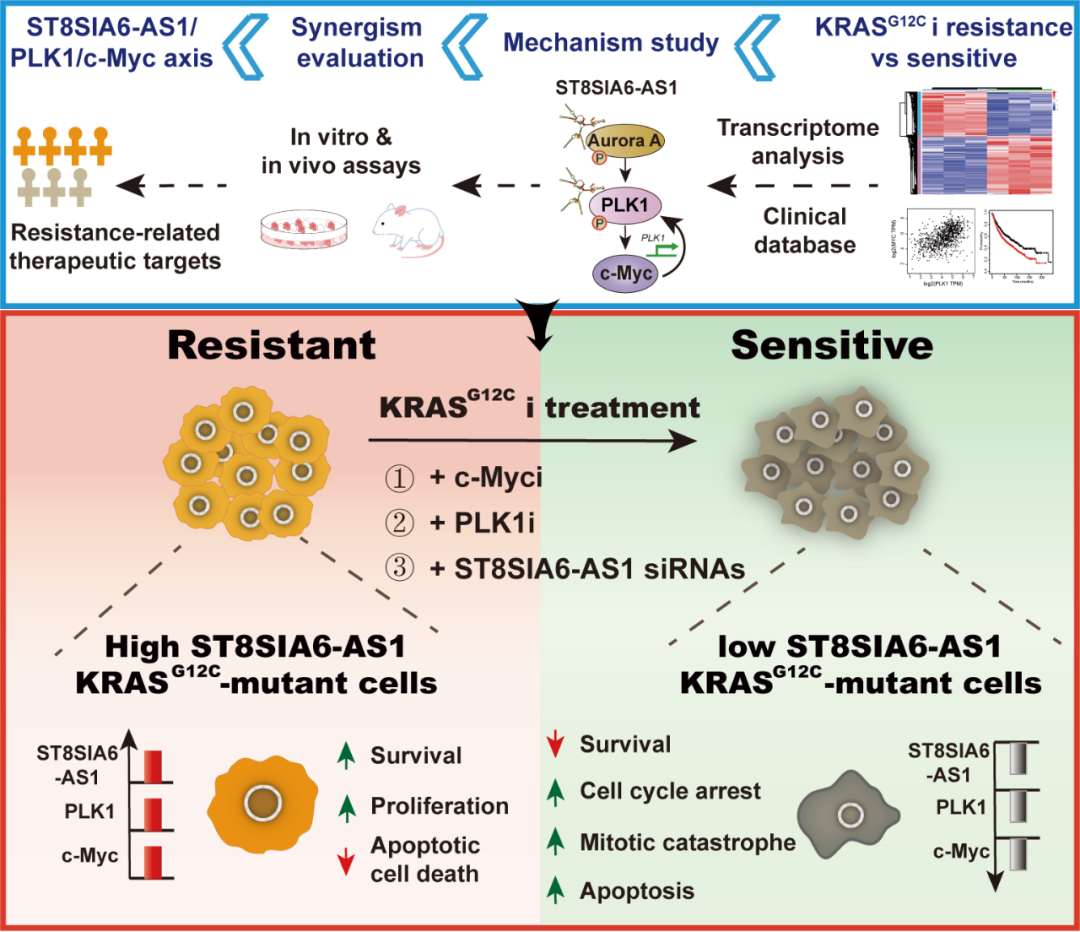
图1. 同时靶向KRAS和ST8SIA6-AS1/PLK1/c-Myc通路导致KRASG12Ci耐药细胞协同致死的机制示意图。
上海科技大学免疫化学生物学课题组助理研究员王亚芳和中国科学技术大学博士研究生姚明月(上海科技大学访问生)为论文共同第一作者。谢成英研究员为论文的通讯作者。上海科技大学为第一完成单位。该项工作得到了上海科技大学、临港实验室、上海市自然科学基金委、上海市科委的大力支持。
https://doi.org/10.1186/s40164-023-00466-3



