近期,我所抗体结构课题组解析了人类冠状病毒229E的刺突蛋白的融合后构象,分辨率高达1.86 Å。 9月1日,该研究成果以“Crystal structure of the post-fusioncore of the Human coronavirus 229E spike protein at 1.86 Å resolution”为题,在国际期刊《Acta Crystallographica Section D:Structural Biology》上以research paper在线发表。
冠状病毒是一组高度多样化的包膜、单股正链RNA 病毒(27-32 kb)。自第一例冠状病毒在1930s被发现以来,目前已经确认有六种冠状病毒毒株可以感染人体,分别是α属的 229E、NL63、以及β属的 OC43、HKU1、SARS及MERS。其中的SARS与MERS曾在2002与2013年分别在全球大规模爆发,不仅造成极大的社会经济损失,同时其超高的传染性与致死率也在世界范围内引起了极度的恐慌。截止目前为止,尚无针对冠状病毒的广谱疫苗或特效药物,冠状病毒对于人类健康仍是一个潜在的巨大威胁。而229E作为人冠状病毒的主要流行株之一,感染呈全球性分布。该病毒致病性广泛,可诱发自限性的急性感染和慢性持续性感染,引发诸如急性呼吸道疾病、肠炎、脑炎以及中枢神经系统的慢性脱髓鞘等疾病。
在冠状病毒入侵细胞的过程中,冠状病毒的刺突蛋白S(I型糖蛋白)介导病毒包膜与宿主细胞膜或内膜的膜融合这一至关重要的一步,因而是冠状病毒药物研发的重要靶标之一。目前针对于冠状病毒和宿主细胞的膜融合过程,领域内普遍接受的理论是刺突蛋白S所介导的attachment, transition 和post-fusion三步膜融合模型。其中,从transition状态到post-fusion状态的转换主要由刺突蛋白S的HR1和HR2基序介导,而二者在进化中较为保守,尤其具有成为泛-冠状病毒广谱抑制剂研发靶点的潜力。实际上,设计靶向HR1的小分子药物或HR2模拟肽一直是抗冠状病毒的药物研发热点。在本研究中,抗体结构研究组的研究人员们成功解析出人冠状病毒229E的HR1和HR2基序所形成的 6螺旋束的高分辨率结构。通过和已经报道了的SARS、MERS以及和NL63的相应结构进行细致的分析比较,研究人员发现1) a-属和b-属的人冠状病毒的HR1所形成的疏水内核虽然整体结构大致相似,但是其表面静电分布呈现出较大不同,其中在部分位点,α-HCoV和β-HCoV甚至呈现出相反的电荷分布(图1);2) HR1与HR2基序之间的疏水相互作用在不同种属的冠状病毒之间高度保守;3)部分HR1与HR2基序之间的静电相互作用也在不同的冠状病毒之间高度保守(图2),提示其在进化中功能上的重要性。上述研究成果所揭示的人冠状病毒a-属与b-属之间的共性与不同为研究人员进一步设计广谱的抗冠状病毒抑制剂提供了理论基础。
该研究中,2017级博士研究生严磊为第一作者,抗体结构课题组研究副教授杨贝和特聘教授Ian A. Wilson为共同通讯作者,上科大免疫化学研究所为第一完成单位。这项研究的完成得益于上海同步辐射光源给予的稳定机时支撑,以及上科大启动基金、国家自然科学基金和上海市科学技术委员会基金的支持。
https://doi.org/10.1107/S2059798318008318
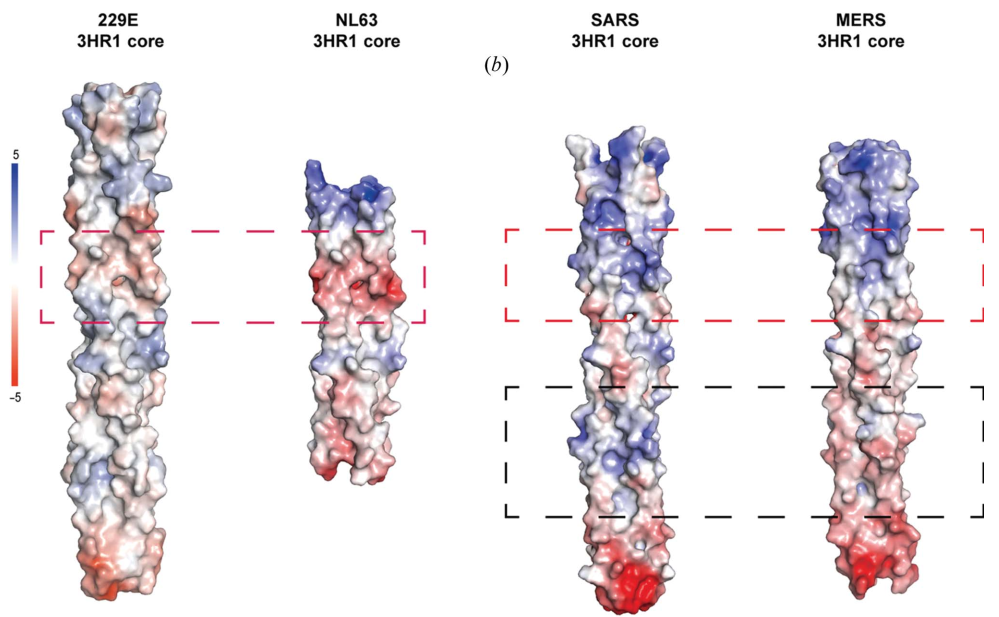
图1 在部分位点,α-HCoV和β-HCoV的疏水核心呈现出相反的电荷分布
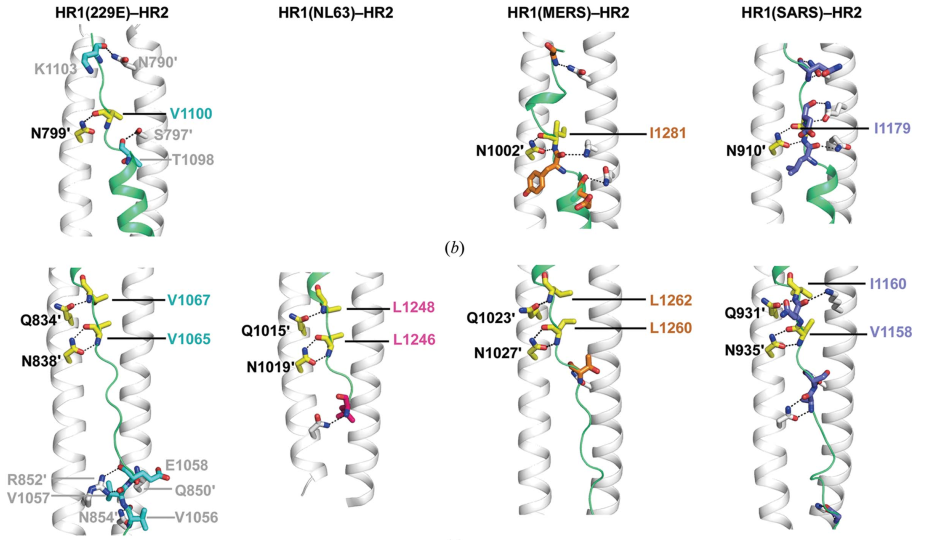
图2 部分HR1与HR2基序之间的静电相互作用在不同的冠状病毒之间高度保守



