
实验室综合运用包括整合结构生物学、生物大分子质谱、基因编辑等在内的前沿技术体系,结合多种体外、体内评估手段,致力于解决具有临床意义的重要生物学问题。我们期望加入实验室的研究生具有旺盛的科学好奇心,百折不挠的毅力以及乐于助人、合作共赢的开放胸怀。我们鼓励学生进行原创性探索、发展批判性思维,也致力于为各位同学提供自由的学术氛围和了解掌握不同前沿技术的机会。
现阶段,本实验室主要针对一系列高风险传染性疾病(如艾滋病等)以及遗传性罕见病(如地中海贫血等)开展分子病理机制方向的探索,并致力于针对这些疾病鉴定新型治疗靶点和开发相应的预防新手段(如新型疫苗)与治疗新方法(如基因治疗)。

近5年代表性科研成果:
1、碱基编辑工具开发与应用:通过整合TALE的定位功能和双链DNA碱基脱氨酶DddA的碱基编辑功能构建而成的线粒体碱基编辑器DdCBEs为线粒体相关遗传性疾病提供了新的治愈可能。然而,DdCBE较高水平的脱靶编辑和旁观者编辑限制了它们在临床治疗中的实际应用。为解决上述问题,我们解析了线粒体胞嘧啶碱基编辑器DdCBE分别靶向两个内源性线粒体基因位点的高分辨率冷冻电镜结构,并根据其所揭示的机制信息开发了可用于指导TALE识别区与spacer长度设计的编辑窗口预测模型(WinPred)和高精度型DdCBE(aDdCBE),成功实现了单碱基精度的线粒体DNA编辑和对线粒体疾病的精准模拟,研究成果为未来线粒体疾病的造模和基因治疗提供了有力工具(Mol Cell, 2025)(图1)。在开发和优化基因编辑工具的基础上,我们也初步探索了导向编辑技术在高风险传染性疾病的预防方向的应用潜力(Medcomm., 2023),更与合作者一同推动了新型碱基编辑技术在遗传性疾病–地中海贫血症–治疗中的实际应用,部分临床前概念验证研究成果已发表(Cell Stem Cell, 2023)。该研究利用高精准、无脱靶的变形式碱基编辑系统tBE对γ-珠蛋白的启动子区域进行精准碱基编辑,重新激活了γ-珠蛋白的表达来替代存在基因缺陷的β-珠蛋白,从而重建了血红蛋白的携氧功能。
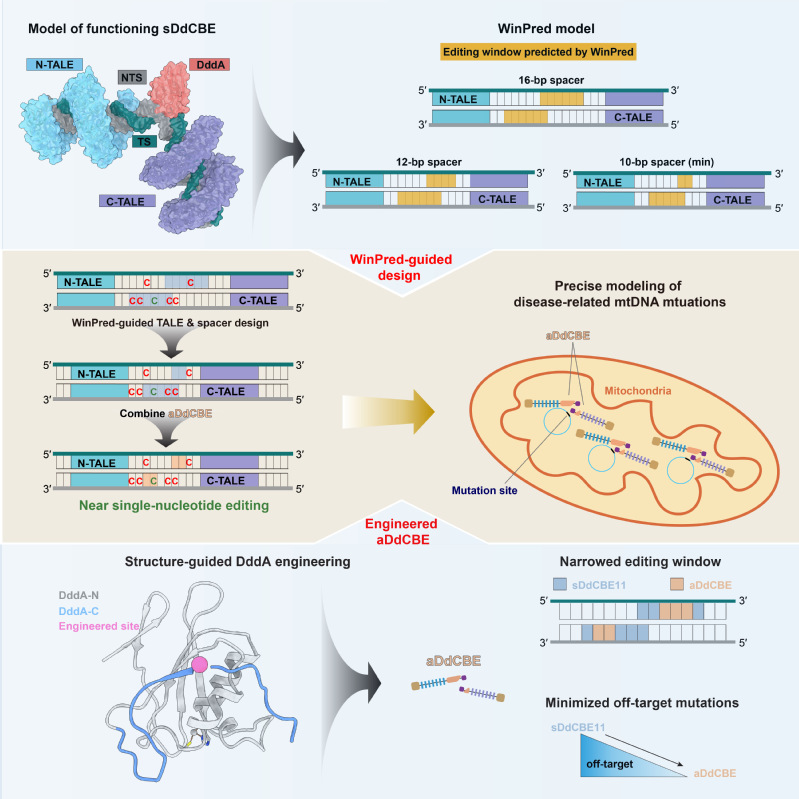
图1、结构指导下的高精准线粒体碱基编辑器开发
2、广谱疫苗靶点发掘:位于HIV-1病毒表面的Env蛋白三聚体是艾滋病疫苗研发的焦点。当前,针对艾滋病疫苗研发困境的破局途径之一是在少数广谱中和抗体的表位指引下开展结构指导的“免疫聚焦型疫苗设计”,其核心思想是通过结构指导的反向蛋白质工程设计,在屏蔽Env蛋白上无效或非广谱表位的同时将广谱中和抗体的抗原表位特异性地呈递给宿主的免疫系统,从而使宿主的免疫应答聚焦在这些保守的“免疫脆弱点”区域,进而引发广谱、高效的体液免疫反应来预防感染。而该策略的开展不仅需要广谱中和抗体抗原表位的指引,更需要对不同亚型Env蛋白的结构与抗原特征进行全面掌握。通过研究,我们报道了我国HIV-1病毒的主流亚型(即流行重组亚型CRF01_AE和CRF07_BC)的Env蛋白结构与免疫识别特征,揭示了CRF01_AE亚型的Env蛋白在V1区域的独有特征(图2A-B)及其与该亚型的广谱中和抗体逃逸能力之间的关系(图2C-D),并阐明了第一株分离自CRF01_AE感染个体的广谱中和抗体的新型中和机制(图2E)。该研究拓宽了我们对于HIV-1流行重组亚型的认识,为后续针对我国主流HIV-1亚型开展免疫聚焦型疫苗设计提供了关键信息 (Nat. Commun., 2023)。 此外,我们还描绘了α属冠状病毒刺突蛋白的抗原图谱,揭示了不同属的人冠状病毒的刺突蛋白之间在抗原特性上的共性与差异,相关研究成果也为开发广谱冠状病毒疫苗提供了理论参考(发表于 Commun. Biol., 2022)。
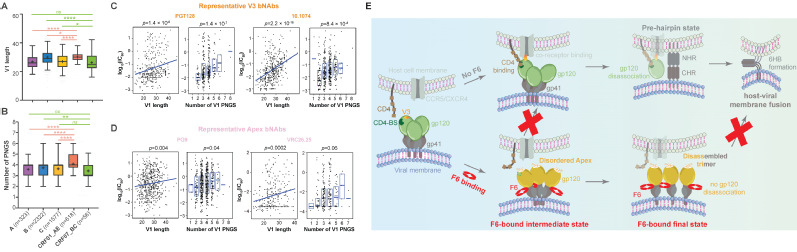
图2、揭示HIV-1流行重组亚型Env蛋白的结构与免疫识别特征
3、新药靶点发掘与相应抑制剂发现:肠道病毒属(Enterovirus)多种病原体引发的感染因其庞大的感染基数每年给全球社会带来巨大的健康和经济负担,而3C蛋白是针对该属病毒开发抗病毒药物的热点。然而,此前针对其酶活性中心开发的抑制剂在动物实验中效果不佳,亟待发掘3C蛋白上新的药物靶点。我们通过研究发现:1)3C蛋白除具有传统的蛋白酶功能外还在该属病毒的基因组复制过程中发挥了关键调控作用,并鉴定出了3C蛋白上负责与病毒基因组5'NCR区结合的相关位点。2)3C蛋白的酶活性可以通过别构调节位点进行调控。上述别构调节位点和基因组结合位点均远离3C蛋白的酶活性中心,同时具有很高的属内保守性,可用于指导后续针对该属病毒的广谱抑制剂研发工作(发表于PNAS, 2020)。进一步,我们通过综合运用DNA编码化合物库和计算机虚拟筛选等技术针对上述两个新靶点开展了大规模的化合物筛选与验证工作,首次发现天然产物二氢杨梅素(DHM)能特异性靶向3C蛋白的别构调节位点,非竞争性地抑制包括柯萨奇病毒、脊髓灰质炎病毒、肠道病毒71等在内的多种肠道病毒的3C蛋白酶活性,进而通过阻断病毒多蛋白前体的切割来抑制病毒复制,实现广谱抗病毒效应,其在抗病毒实验中的选择性指数CC50/IC50超过700,具备优异的剂量窗口,有望作为抗肠道病毒药物的候选分子被进一步优化和继续开发(Adv Biol, 2025)。