我所T细胞工程实验室朱学锴副研究员与生命学院黄行许教授合作,开发了基于非病毒载体制备基因编辑嵌合抗原受体(CAR)T细胞的新技术。研究人员在人T细胞中通过转座子系统稳定整合并表达了CD133特异性CAR,同时利用CRISPR/Cas9系统实现了PD-1基因的高效率敲除。近期,相关成果以“Nucleofection withPlasmid DNA for CRISPR/Cas9-Mediated Inactivation of Programmed Cell DeathProtein 1 in CD133-Specific CAR T Cells”为题于基因治疗领域著名期刊《HumanGene Therapy》上在线发表。
使用病毒载体转染T细胞,是目前CAR-T细胞疗法的主流方向。但临床级别病毒载体的制备和质控成本非常高,目前全球仅有几家单位有资格和能力提供临床级别的CAR病毒载体。另外,CRISPR/Cas9介导的基因编辑CAR T细胞需要Cas9的存在,为了避免异源Cas9蛋白在T细胞中稳定表达而引起免疫源性,通常使用电转的方法保证Cas9仅在T细胞中短暂存在。T细胞工程实验室长期致力于研究以非病毒载体递送基因至T细胞中的方法。在该研究中提出了将CRISPR/Cas9与转座子系统联用,以质粒为载体,在T细胞中一步法实现基因编辑和CAR的表达。研究人员进一步证实了该技术可以制备基因编辑CAR T细胞,CAR表达和基因编辑效率均可以满足临床需求(见图1)。非病毒载体质粒递送基因相对于病毒载体转染的优势包括成本有望降至后者的1/10,递送载体容量更大等。
近年来,以CAR T细胞和PD-1/PD-L1阻断抗体为代表的免疫疗法的成功,使得癌症治疗进入了新的时代。2018年的诺贝尔生理学或医学奖也授予给了在免疫检查点CTLA-4和PD-1的阻断疗法中做出重要贡献的科学家。将CAR T细胞与免疫检查点抑制联合使用,从而对抗实体瘤的免疫抑制环境并降低检查点阻断抗体带来的系统性免疫相关副作用,一直是肿瘤免疫治疗领域的研究热点。在本研究中,研究人员利用基因编辑CAR T细胞技术,成功将CD133-CAR T细胞中的PD-1基因敲除。并且发现相比较于传统CAR T细胞,PD-1基因沉默的CD133-CAR T细胞在体外杀伤肿瘤细胞能力更强,动物实验显示显著延长荷瘤小鼠的寿命和抑制肿瘤生长(见图2)。
在未来的研究中,T细胞工程实验室将使用这项技术研究未知的影响T细胞功能的调节因子,开发功能强大的CAR T细胞或者通用CAR T细胞,为解决实体瘤难治和自体CAR T细胞制备困难等问题提供新策略。
该研究中,我校生命学院黄行许研究组博士研究生胡边为第一作者,朱学锴副研究员与黄行许教授为共同通讯作者。
相关研究报道见:https://www.liebertpub.com/doi/full/10.1089/hum.2017.234
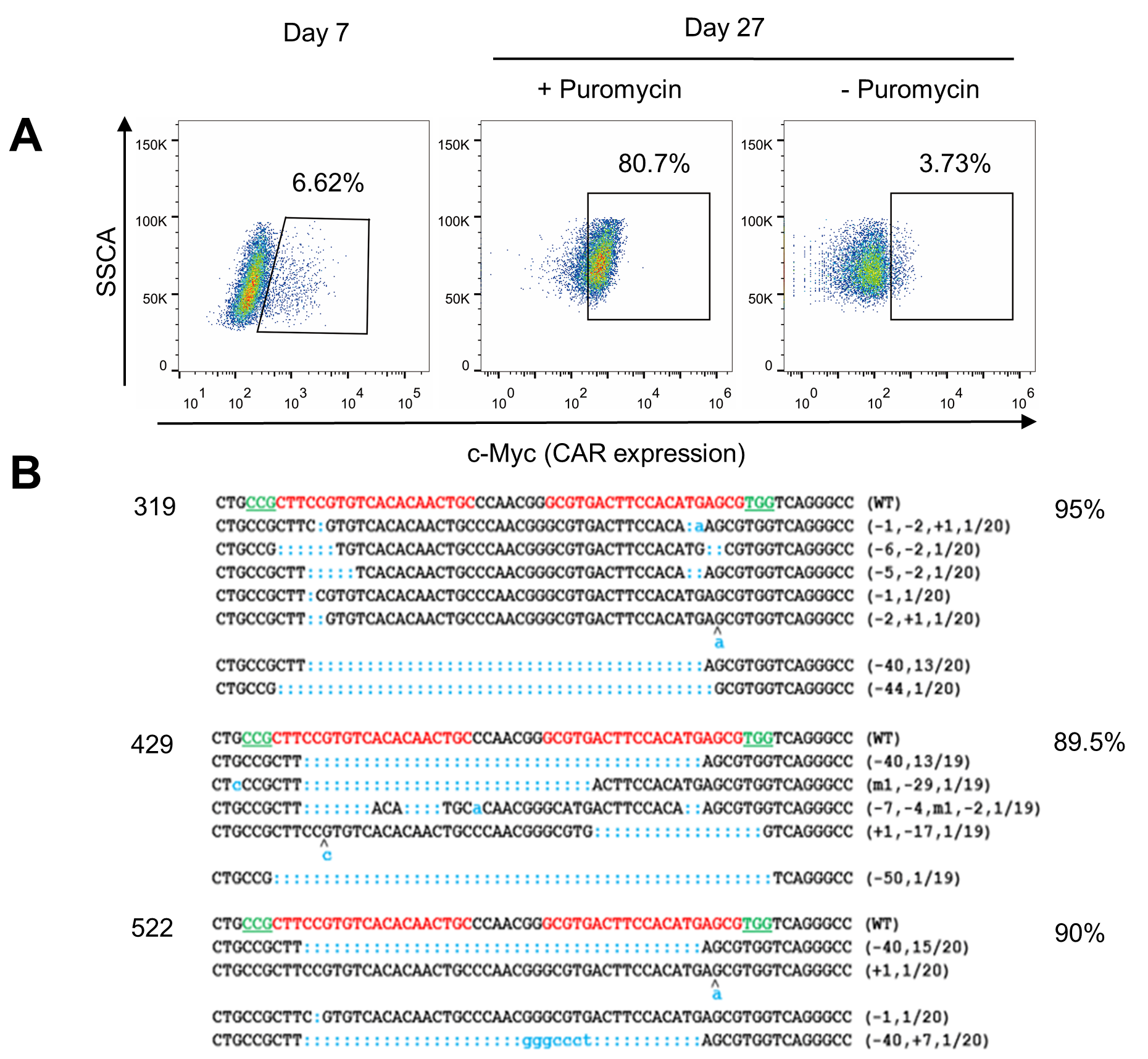
图1:非病毒载体在人T细胞中同时实现高表达CD133-CAR和高效率敲除PD-1基因
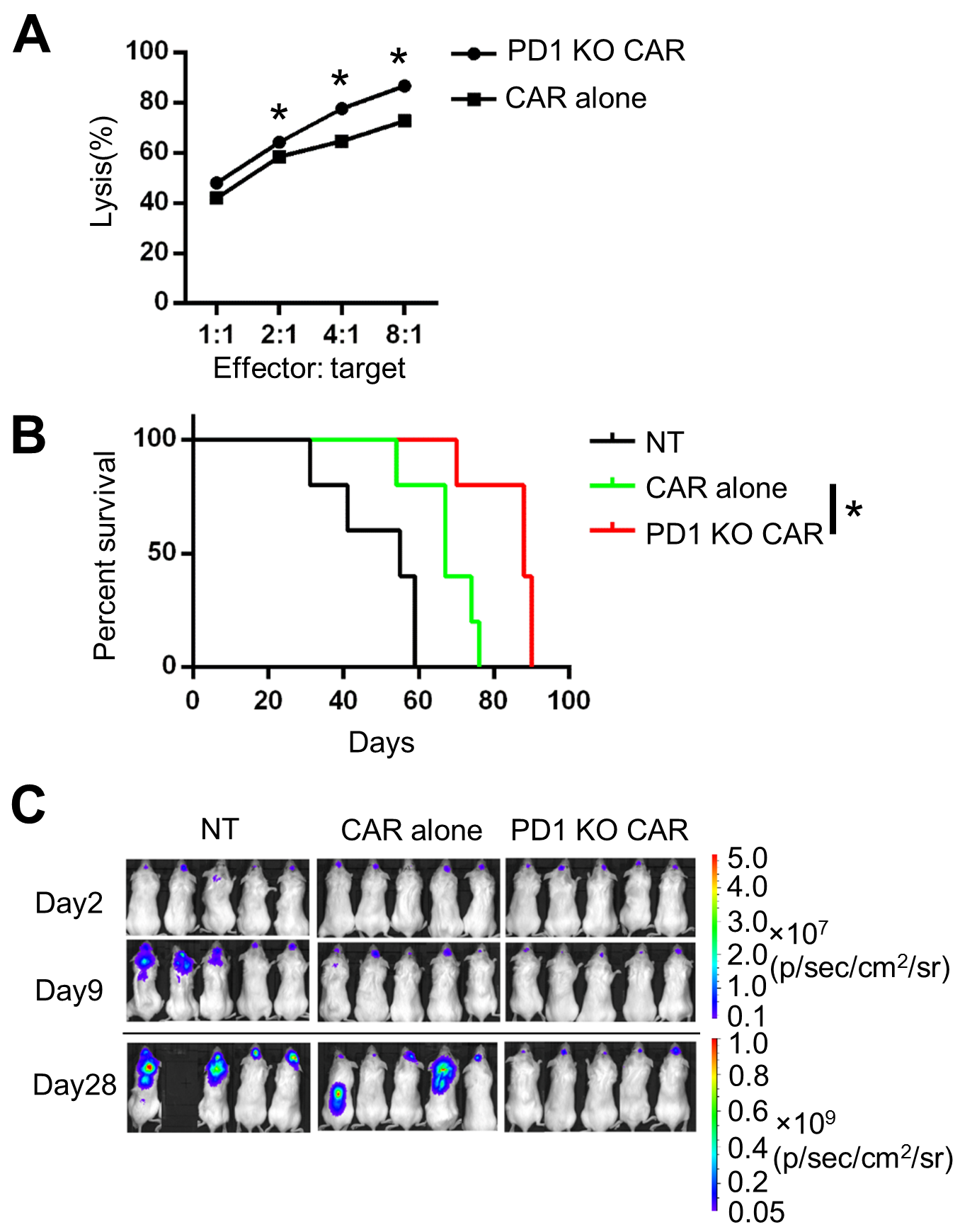
图2:PD-1基因沉默的CD133-CAR T细胞显示更强的抗肿瘤功能



