近日,免疫化学研究所教授Katsuhiko Mikoshiba与法国教授Valentin Nägerl研究组Nature Communications发表文章,揭示了星形胶质细胞的形态学奥秘。文章题为“Structural basis of astrocytic Ca2+ signals at tripartite synapses”,Mikoshiba研究组的前博士生Misa Arizono是第一作者。
星形胶质细胞是大脑中数量最为众多的神经胶质细胞,它们利用钙离子信号调节其生化活性以及与其它脑细胞进行交流。虽然单个星形胶质细胞可以很好地定位并非常灵巧地影响位于其解剖学区域内的数千个神经元突触,但长期以来,基于对躯体和星形胶质细胞主要分支的低分辨率成像研究,人们认为星形胶质细胞Ca2+信号过于迟缓和分散,因而无法介导任何快速和特定的行动。
近年来,针对微小但相关的星形细胞的研究表明,其快速和局部的突触Ca2+信号介导了与神经元相似的高速的点对点通信。然而,由于难以解析星形胶质细胞(和突触)复杂的形态,同时也难以追踪它们在活脑组织中的Ca2+活性,星形胶质细胞这种特异性信号传导的解剖学基础仍不清楚。为了解决这个问题,本研究利用了3D-STED显微镜,它提供了比常规光学显微镜更高的空间分辨率,可以揭示星形胶质细胞和神经元形态上的更多细节。本研究通过共聚焦Ca2+成像监测Ca2+活性以及荧光漂白恢复(FRAP)实验评估生物物理性质,阐明了星形胶质细胞Ca2+信号的解剖学基础。本研究观察到,星形细胞形成了网状的节点和轴,并形成环状结构。这些节点自发产生Ca2+信号,这些信号大部分时间停留在局部,也可以通过轴向邻近节点传播。FRAP实验证实,星状细胞的节点/轴结构通常支持分段信号,但也允许信号跨多个节点传播。将Ca2+数据映射到形态学的STED图像上,显示大多数星形细胞Ca2+信号与单个突触相关,从而表明星形细胞能够参与突触特异性通信。
总之,本研究为活脑组织(器官型、急性脑切片和体内)星形胶质细胞的纳米级组织形态提供了证据,证明了星形胶质细胞节点作为一种难以解析的解剖结构,可能在单一的“三边突触”上起到调节神经元通讯的功能。
原文: Structural basis of astrocytic Ca2+ signals at tripartite synapses, Nature Communications volume 11, Article number: 1906 (2020), https://www.nature.com/articles/s41467-020-15648-4
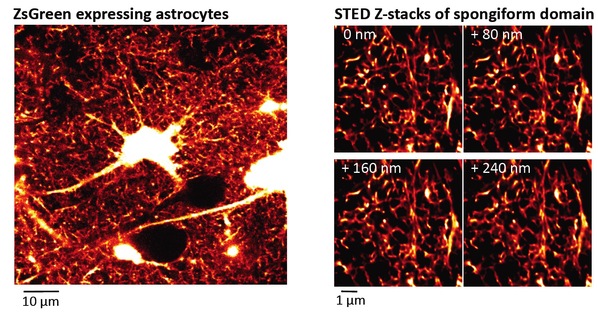
图1.实时STED显微技术揭示星形胶质细胞海绵状结构域
左图:共聚焦显微镜图像显示表达ZsGreen的星形胶质细胞
右图:显示出复杂的网状结构的海绵状区域,其Z-轴STED成像
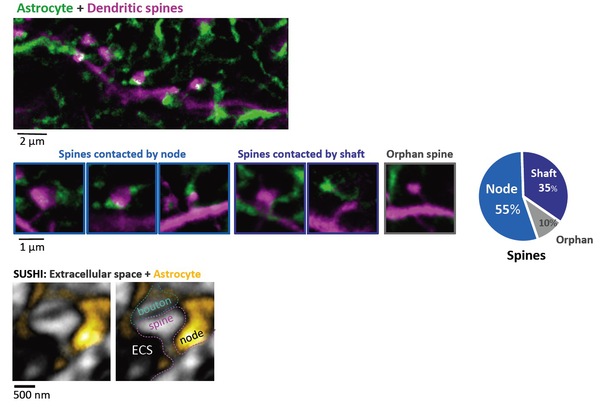
图2. 多数树突棘与星形细胞通过“节点”接触
上图:星形细胞海绵状结构域(绿色)和树突(品红)之间的形态相互作用的双色STED成像
中图:棘接触节点,轴,和缺乏星形细胞结构的棘附近的图像(左)和百分比(右)
下图:围绕着突触(灰色)和星形胶质细胞(黄色)的细胞外空间(黑色)。右图指示出突触的不同结构。



