新冠病毒肺炎疫情至今已造成全球1.4亿人感染和300余万人死亡。随着疫情进展,突变病毒株不断出现,对中和抗体和疫苗的防护效果提出了严重挑战,迫切需要针对各型突变株中高度保守的转录复制过程开展深入研究,阐明关键药物靶点的工作机制,发现能够有效应对各种突变株的抗病毒药物。
新冠病毒是目前已知RNA病毒中基因组最大的一种病毒(约30 kb),其基因组编码了一系列非结构蛋白,并按照一定的空间和时间顺序,形成复杂的超分子蛋白质机器“转录复制复合体”(RTC),负责病毒转录复制的核心过程,包含了众多保守的抗病毒药物设计的关键靶点。由于基因组极大,同时聚合酶复制保守性较差,新冠病毒进化出一种独特的“复制矫正”(proofreading)机制,利用转录复制复合体中关键的nsp14蛋白对复制过程进行矫正,一旦发现聚合酶合成了错误配对的碱基,立刻通过nsp14具有的外切核酸酶(ExoN)将错误碱基处理掉,保证复制的准确进行,这也是病毒逃逸核苷类抗病毒药物的关键途径。同时,nsp14是一个独特的双功能蛋白,除负责复制矫正的外切核酸酶外,还拥有一个N7甲基化酶(N7-MTase),负责mRNA加帽过程关键的第三步催化反应。复制矫正和加帽过程如何进行,特别是两个截然不同的生化过程如何在一个nsp14蛋白中协同作用,是20多年来冠状病毒研究领域中关键的几个“未解之谜”之一。
2021年5月24日,上海科技大学饶子和院士、高岩博士与清华大学娄智勇教授团队合作在Cell发表研究论文Coupling of N7-methyltransferase and 3'-5' exoribonuclease with SARS-CoV-2 polymerase reveals mechanisms for capping and proofreading,解析了新冠病毒超分子蛋白质机器“转录复制复合体”关键状态的三维结构,揭示了病毒mRNA加帽、基因组复制矫正、逃逸核苷类抗病毒药物的分子机制。这是该团队在新冠病毒转录复制复合体研究中,继在Science、Cell等期刊上连续发表4项成果后的又一重要工作。

新冠疫情爆发后,该团队针对新冠病毒转录复制机制开展的深入研究,先后阐明了“核心转录复制复合体”(C-RTC)、“延伸转录复制复合体”(E-RTC)和“加帽中间态转录复制复合体”[Cap(-1)’-RTC]的工作机制。在此基础上,研究团队成功解析了Cap(-1)’-RTC与nsp10/nsp14形成的超级复合体Cap(0)-RTC的三维结构(图1)。
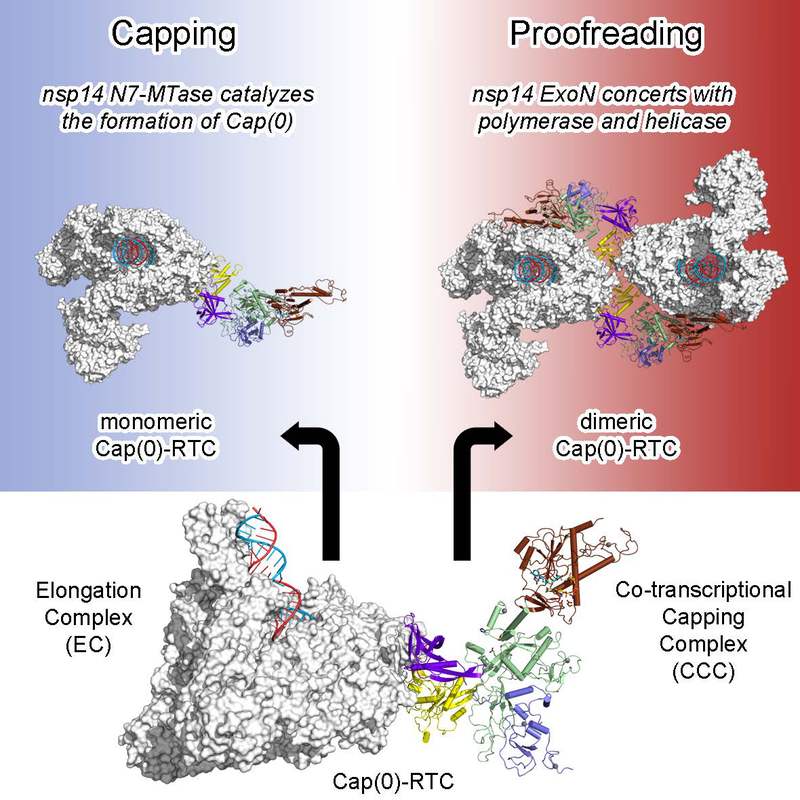
图1 新冠病毒Cap(0)-RTC的工作机制
在该复合体中,nsp9蛋白发挥了“适配器”(adaptor)的作用,通过与nsp14蛋白相互作用,将nsp10/nsp14复合体招募到Cap(-1)’-RTC中,从而利用nsp14的N7甲基化酶结构域完成mRNA加帽过程的第三步关键反应。尤为重要的是,研究团队发现Cap(0)-RTC在溶液状态下会形成稳定的同源二聚体。在二聚体中,解旋酶nsp13通过其1B结构域的重大构象变化,引导模板核酸链反向移动,引发产物链backtracking机制,从而将产物链3’末端传输至另一Cap(0)-RTC的nsp14外切核酸酶结构域的反应中心,完成错配碱基的矫正过程(图2)。
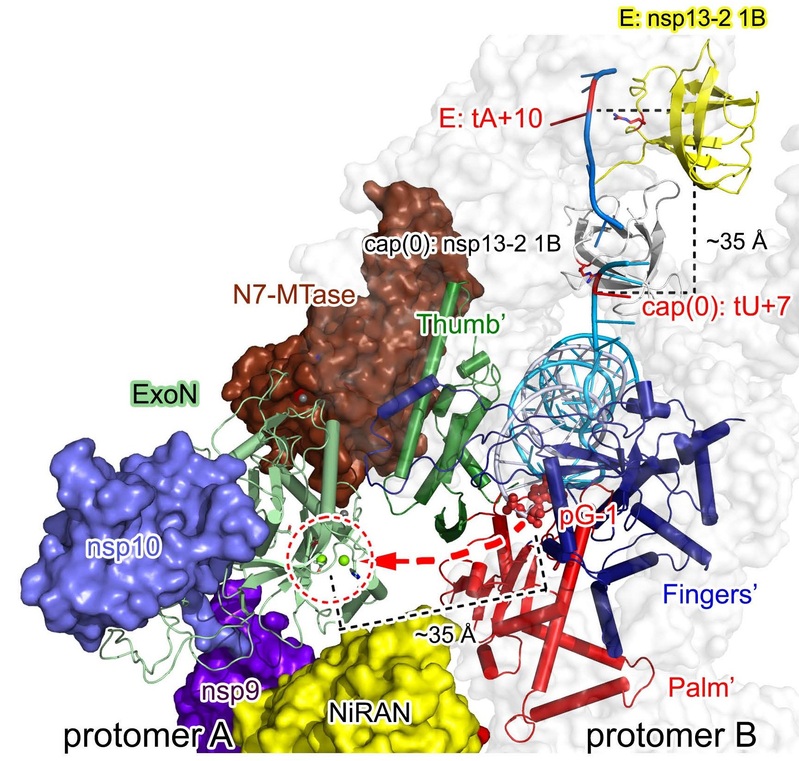
图2 新冠病毒复制矫正的in trans backtracking机制
这一发现所提出的in trans backtracking的复制矫正机制,与真核/原核细胞RNA聚合酶Pol II的复制矫正机制具有一定的类似性,表明作为基因组最复杂的RNA病毒,新冠病毒的转录复制过程已与高等生物具有一定的类似性,阐明了冠状病毒研究领域20多年来悬而未决的关键科学问题。同时,复制矫正机制是新冠病毒逃逸核苷类抗病毒药物(如瑞德西韦)的关键机制,一旦核苷类药物被加入RNA产物链中,即会被病毒的复制矫正过程去除,从而丧失抑制活性,目前仅有NHC及其衍生物可以逃逸该过程。该成果也将对未来进一步优化和发展新型核苷类抗病毒药物提供关键的结构基础。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(21)00663-2
改写自:BioArt微信公众号文章;作者/来源:BioArt



