近日,上海科技大学免疫化学研究所白芳课题组与中国科学技术大学物理系汪骞研究员、中科院武汉病毒所张磊砢副研究员合作,通过计算模拟预测与实验验证结合,揭示了新冠病毒刺突蛋白动态变构分子机制,探索并提出了潜在的变构抑制剂设计策略。该成果以“Probing the Allosteric Inhibition Mechanism of a Spike Protein Using Molecular Dynamics Simulations and Active Compound Identifications”为题,于8月20日在学术期刊Journal of Medicinal Chemistry上在线发表。
冠状病毒通过其跨膜刺突蛋白(Spike protein,S)介导入侵宿主细胞。S蛋白为附着在病毒粒子表面的三聚体蛋白,由S1和S2两个亚基组成,其与宿主受体的识别结合的结构域RBD则位于S1亚基上。冷冻电子显微镜研究表明,刺突蛋白具有多种不同的构象状态,在RBD处于“向下”的非激活状态构象和“向上”的激活状态构象之间不断的转变,只有当其处于“向上”的状态时,才能与宿主的受体结合。因此,系统了解S蛋白的上述动态变构过程,并探索其构象变构抑制剂设计位点具有重要意义。
研究人员以电镜获得的S蛋白的“向上”与“向下”的构象作为双阱(态)结构模型,特别设计了粗粒度分子动力学模拟物理模型,通过系统的模拟计算,获得了三聚体S蛋白在上述两个结构间转换的动态变构全过程,从中发现RBD结构域在“向上”与“向下”间的转换是通过S蛋白的SD1亚基与SD2亚基之间相对运动、协同变化实现(如图1所示)。基于模拟获得的蛋白分子过渡态构象,结合可药性位点搜索方法计算发现位于SD1与SD2亚基之间的潜在变构口袋,借助活性化合物虚拟筛选方法,并结合分子生化实验与抗病毒活性实验验证,获得3个具有一定抗病毒活性的苗头化合物,这些化合物可能“粘连”刺突蛋白不同结构域,从而稳定刺突蛋白的构象,阻碍其向“向上”的激活构象态变化,进一步阻碍病毒入侵(图2)。
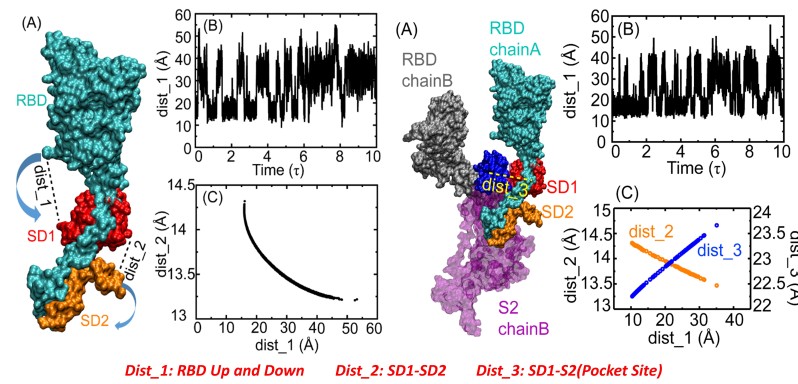
图1. 基于计算模拟揭示的刺突蛋白动态变构行为分子机制。
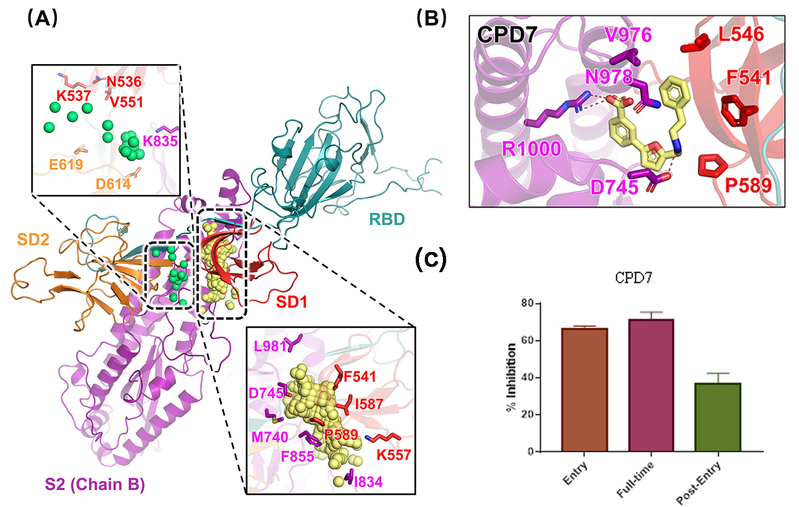
图2. A-B)刺突蛋白潜在变构抑制剂设计位点与苗头化合物预测结合模式。 C)代表性苗头化合物的抗病毒分子作用机制。
中国科学技术大学研究员汪骞、上海科技大学生命学院2021届博士研究生王林和中科院武汉病毒所博士后张宇旻为本文的共同第一作者。白芳、汪骞、中科院武汉病毒所尚卫娟为本文共同通讯作者,白芳课题组博士后张向磊完成了本工作中的分子水平结合实验工作。该研究得到了上海市科委、国家自然科学基金与上科大启动经费、中国科学技术大学青年创新重点基金、中国科学院青年创新促进会项目等的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.1c00320



