3月25日,上海科技大学免疫化学研究所杨海涛团队联合天津大学、重庆医科大学、耶鲁大学的科学家共同在《自然-通讯》(Nature Communications)上发表研究论文,报道了通过设计沃尔巴克氏菌胞质不相容性因子,实现了人工操纵胞质不相容。这种本由细菌引发的胞质不相容性现象被用于控制蚊虫种群的数量,从而达到防治虫媒疾病的目的。此项研究成果是该团队近期继揭示胞质不相容性的分子机制之后,在抗蚊媒疾病研究领域取得的又一重要进展。
沃尔巴克氏菌(Wolbachia)可通过诱导两性配子结合时的胞质不相容性现象(Cytoplasmic Incompatibility,CI)导致蚊虫“不孕不育”,从而达到控制蚊虫种群数量的目的,是一种高效绿色的生物防治方法。利用该技术可有效控制登革热、寨卡等蚊媒疾病在世界范围内的传播。胞质不相容性是由两种相互关联的蛋白导致的,分别被称为胞质不相容性因子A (CI factor A, CifA)和胞质不相容性因子B (CifB)。在先前的研究中,该联合研究团队发现CI因子之间的互作是Wolbachia产生CI现象的关键因素。该研究团队据此提出新的设想:能否通过操纵CI因子的互作控制CI现象?这将为设计新型CI因子以更有效地控制蚊媒病毒传播提供重要工具。
为了验证以上设想,研究团队对来自两种不同的Wolbachia菌株(wPip、wMel)的CI因子进行了全面的结构、生化和功能研究。由于其CifB具有去泛素化酶活性(deubiquitylase),这些因子被命名为Cid(包括CidAwMel-CidBwMel,CidAwPip-CidBwPip)。研究团队解析了两类不同CI因子的复合物结构(图a-b)。以此为基础,对野生型CidAwMel进行了人工改造,得到名为CidAwMel(ST)的人工嵌合蛋白。在随后功能测试中,CidAwMel(ST)果然能与来自不同菌株的CidBwPip发生相互作用,且能够拯救CidBwPip诱导的酵母生长缺陷(图c-d),与预期结果相符。研究团队进一步解析了CidAwMel(ST)-CidBwPipND1-ND2的复合物结构,证实了人工设计CI因子互作界面氨基酸对结合特异性的贡献(图e)。以上研究通过人工设计CI因子并调控它们间的相互作用,首次实现了人工操纵胞质不相容。这一成果对今后利用Wolbachia和CI防控蚊媒疾病和农业虫害具有重要意义。
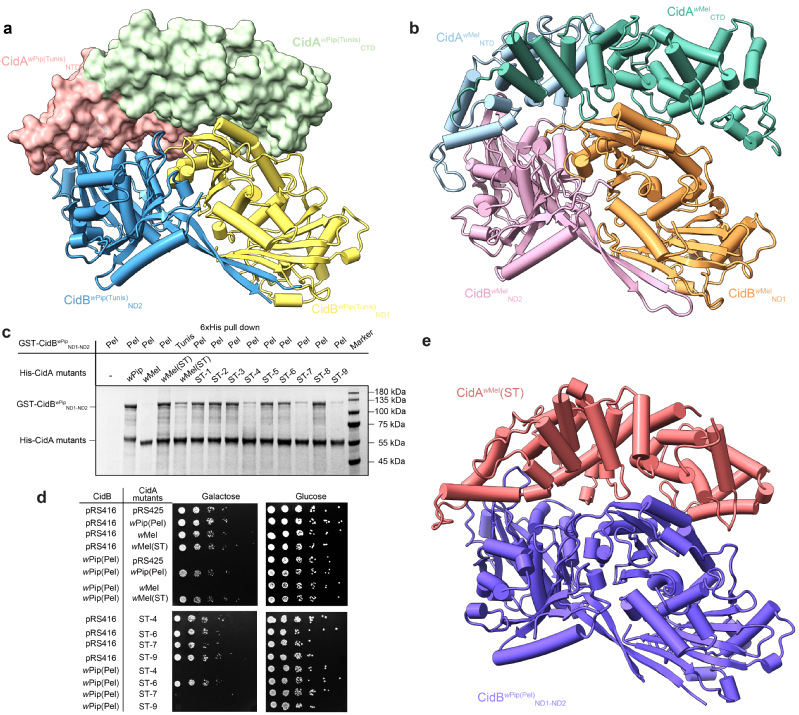
图:人工设计的CI因子操纵CI的产生和拯救。(a) CidAwPip(Tunis)-CidBwPip(Tunis)ND1-ND2复合物三维空间结构;(b) CidAwMel-CidBwMelND1-ND2复合物Alphafold预测模型;(c) 人工嵌合蛋白CidAwMel(ST)能与来自不同菌株的CidBwPip产生相互作用;将人工嵌合蛋白CidAwMel(ST)相互作用界面氨基酸分别进行回复突变(得到CidAwMel(ST-1)~CidAwMel(ST-9)),其中区域4、7和9回复后则不能与CidBwPip互作;(d) 人工嵌合蛋白CidAwMel(ST)能够拯救CidBwPip诱导的酵母生长缺陷;(e) CidAwMel(ST) -CidBwPip(Pel)ND1-ND2复合物三维空间结构。
上海科技大学与天津大学联合培养博士研究生王镐锋、天津大学生命科学学院博士后肖云杰、博士研究生陈侠为本论文的并列第一作者。上海科技大学免疫化学研究所和生命科学与技术学院双聘教授杨海涛、天津大学生命科学学院教授王泽方、重庆医科大学生命科学研究院副教授王炜、耶鲁大学教授Mark Hochstrasser为该研究论文的共同通讯作者。
论文标题:Crystal Structures of Wolbachia CidA and CidB Reveal Determinants of Bacteria-induced Cytoplasmic Incompatibility and Rescue
论文链接:https://doi.org/10.1038/s41467-022-29273-w
相关链接:PNAS|破解利用细菌导致蚊子“不孕不育”的分子机制(https://doi.org/10.1073/pnas.2107699118)



