近日,上海科技大学免疫化学研究所刘佳课题组、中国科学院上海有机化学研究所董佳家课题组合作发现,FDA批准上市的创新抗癌药物KPT330以及相关的选择性核输出抑制剂(SINEs) 化合物可以提高基因和碱基编辑的特异性。该成果以“KPT330 improves Cas9 precision genome- and base-editing by selectively regulating mRNA nuclear export”为题,于今年3月17日在Communications Biology在线发表。基于CRISPR的基因工程工具的组成型活性Cas9蛋白可能引发脱靶效应。此前研究表明,蛋白质或小分子CRISPR抑制剂可用于调节Cas9基因编辑和碱基编辑工具的活性与特异性。但这些蛋白质或小分子尚未进行详细的安全性评价,因此在CRISPR-Cas基因编辑治疗中的应用仍需进一步的研究。本研究中,研究人员使用基于EGFP报告基因的活细胞筛选系统来鉴定CRISPR-Cas9的不可逆小分子抑制剂。研究发现,选择性核输出抑制剂 (Selective Inhibitors of Nuclear Export, SINEs) 可有效抑制Cas9核酸酶衍生的基因编辑、碱基编辑和引导编辑工具在细胞上的活性。进一步的机制研究发现,SINEs并不作为Cas9的直接抑制剂起作用,而是通过干扰Cas9 mRNA的核输出过程来调节Cas9的活性。该研究成果是世界范围内首次报道的人体安全性已知(FDA批准上市)的CRISPR-Cas9特异性调节分子,同时也是首个可同时对Cas9基因编辑、碱基编辑和引导编辑工具发挥作用的小分子。本研究对CRISPR-Cas9基因编辑、碱基编辑和引导编辑工具的临床应用具有重要意义。中国科学院上海有机化学研究所和上海科技大学共同持有本研究相关的国际发明专利。上海科技大学免疫化学研究所刘佳课题组已毕业博士研究生崔炎濡、工程师王少杰为本文的共同第一作者。上海科技大学免疫化学研究所刘佳研究员,中国科学院上海有机化学研究所的董佳家教授为共同通讯作者。上海科技大学为第一完成单位。该项目得到了国家自然科学基金、中国科学院战略性先导科技专项等项目的资助。
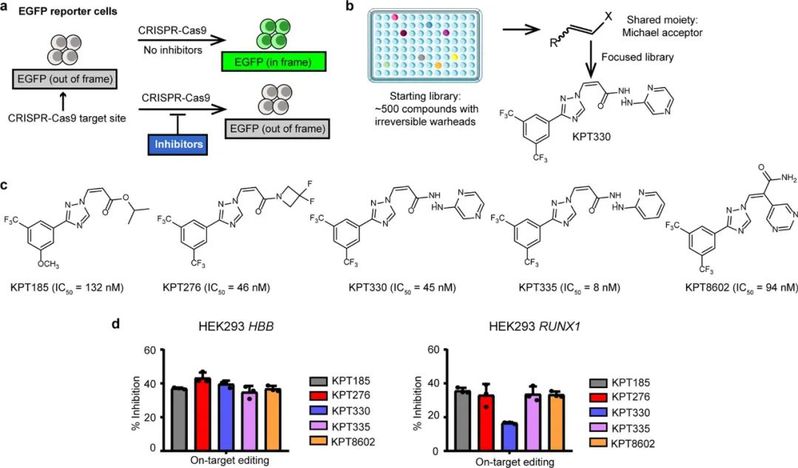
图1. 高通量筛选鉴定选择性核输出抑制剂为CRISPR-Cas9细胞活性的小分子抑制剂。
文章链接:https://www.nature.com/articles/s42003-022-03188-0

