10月4日,国际知名学术期刊《细胞》(Cell)在线发表了上海科技大学免疫化学研究所特聘教授、清华大学教授、中科院院士饶子和,上海科技大学免疫化学研究所副研究员高岩与清华大学教授娄智勇等团队合作的研究成果,报道了在新冠病毒中发现的一种生物界中全新的RNA加帽途径,以及核苷类抗病毒药物抑制该过程的分子机制,并提出全新的“induce-and-lock”的药物设计策略。这是该团队在病毒转录复制机制的研究中,继2020年、2021年在Science、Cell期刊上连续发表5项相关成果后的又一重要的系统性工作。
“帽”(Cap)结构是细胞中广泛存在的一种RNA修饰。多个酶分子通过一系列复杂的催化过程,在RNA 5’端前加入一个G核苷,形成“帽核心”结构(cap core,GpppN),再由甲基转移酶对第一、第二、第三个核苷的不同位置进行甲基化,最终形成Cap0、Cap1、Cap2结构(图1)。在高等生物细胞中,Cap1是最主要的帽结构形式。
帽结构在细胞生命活动中发挥着关键功能。例如在高等生物细胞中,帽结构可维持mRNA的稳定性,防止核酸酶对mRNA的破坏,并能通过帽结合蛋白(cap binding protein)参与mRNA与核糖体的识别,调控蛋白质翻译的顺利进行。作为必须在宿主细胞中表现生命活性的病毒而言,通过宿主或病毒自身编码的蛋白质对病毒mRNA进行加帽,使得其结构与细胞中的帽结构完全相同,能够在保证病毒蛋白质顺利翻译的同时,还可使宿主将病毒mRNA“误认为”是宿主核酸分子,从而逃逸宿主天然免疫的攻击。
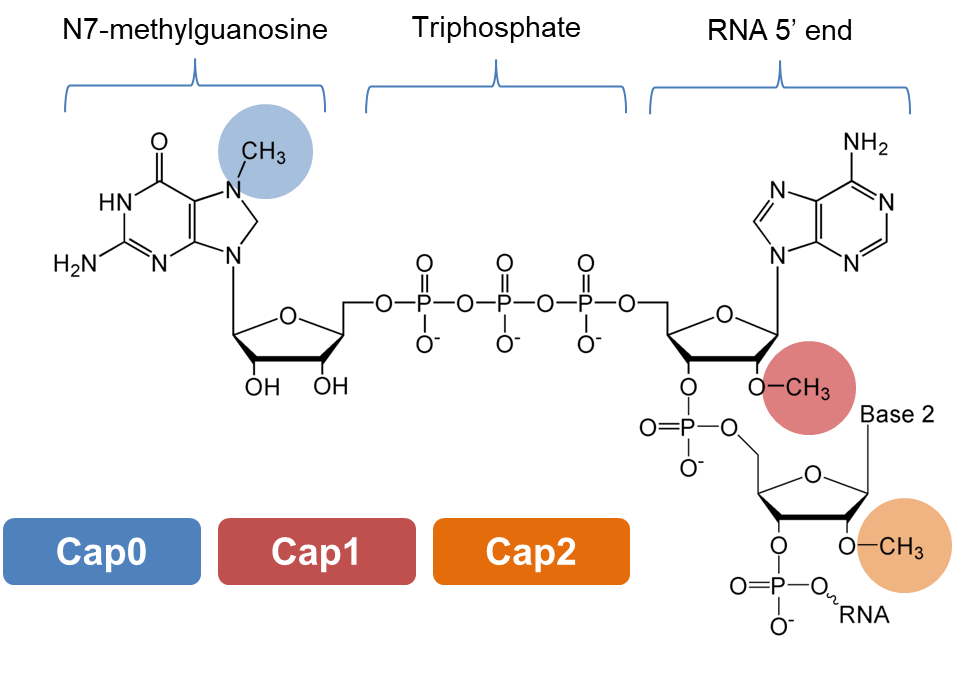
图1 帽(Cap)结构
病毒是一种相对简单的生命形式,是生命科学研究的重要对象。许多重要的生物学概念和生物技术的发展都离不开对病毒的认识,如RNA聚合酶和逆转录现象的发现、冷冻电镜技术发展、基因治疗载体技术等,都源自于病毒研究。新冠病毒是目前已知RNA病毒中基因组最大的一种(约30 kb),在其基因组RNA和mRNA的5’端也必须具备Cap1帽结构。在病毒学传统认知中,冠状病毒核酸的“加帽过程”通过四步反应过程完成(图2,左):解旋酶(nsp13)将新生核酸5’端三磷酸末端水解掉一个磷酸基团,生成二磷酸末端;聚合酶NiRAN结构域在二磷酸末端上加入一个GMP分子,生成帽核心结构(GpppA);nsp14蛋白的N7甲基转移酶结构域进行第一步甲基化,形成Cap0结构(7MeGpppA);nsp16蛋白的进行第二步甲基化,形成成熟的Cap1结构(7MeGpppA2’-OMe)。其中,聚合酶NiRAN结构域在第二步反应的核心功能,以及nsp14蛋白催化第三步反应的结构基础,是本工作团队2020年和2021年在Cell期刊上连续发表两篇论文揭示的。
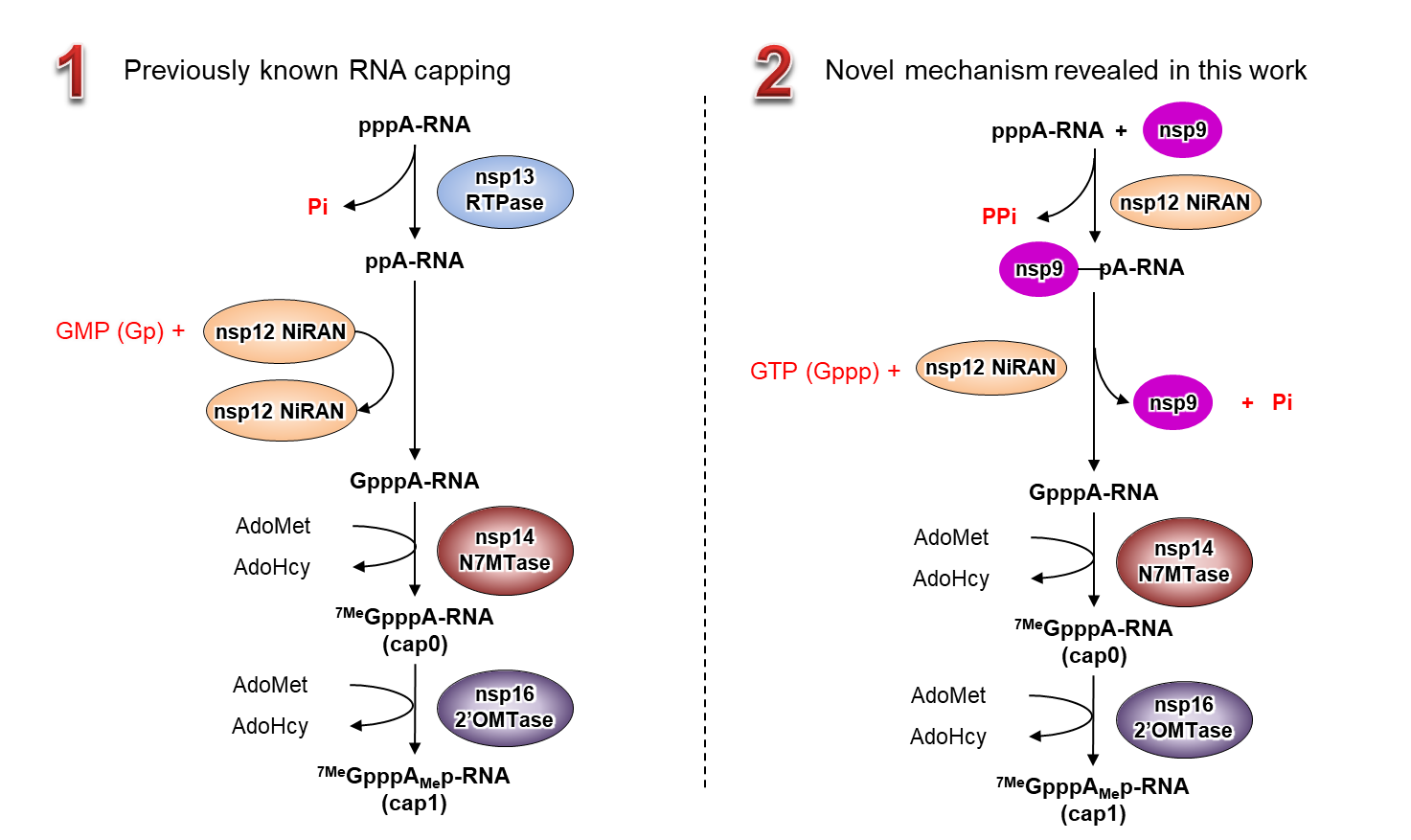
图2 新冠病毒RNA加帽的传统机制(左)和本工作发现的新机制(右)
围绕新冠病毒转录复制过程,团队自新冠疫情发生后开展了系统研究,先后阐明了“核心转录复制复合体”(C-RTC)、“延伸转录复制复合体”(E-RTC)、“加帽中间态转录复制复合体”和“Cap0转录复制复合体”的工作机制。在此基础上,研究团队进一步深入探索了新冠病毒核酸加帽的机制,发现新冠病毒能够利用其转录复制复合体中的单链核酸结合蛋白nsp9作为媒介,介导全新的加帽过程(图2,右)。
该过程分为两个阶段(图3)。第一阶段,聚合酶NiRAN结构域水解新生核酸链5’三磷酸末端成为单磷酸末端,并将剩余的单磷酸末端与nsp9蛋白N端第一个氨基酸(Asn1)的氨基共价连接,形成RNA-nsp9中间产物,该过程被命名为“RNAylation”过程。第二阶段,聚合酶NiRAN在其“G口袋”中结合一个GTP分子,诱导NiRAN结构域发生构象变化,将一个称之为“断键水分子”的水分子向RNA与nsp9共价键的距离推进至3.8 Å,使其发挥亲和攻击能力,导致RNA与nsp9间的共价键断裂,再由断键形成的高能基团攻击GTP,最终形成帽核心结构(GpppA)。这一现象的发现,不仅是对新冠病毒乃至其他病毒生命过程理解的重要更新,而且也是第一次发现这种由蛋白质作为媒介来介导的RNA加帽过程,拓展了生命科学研究中对核酸加工的认识边界,为在人体细胞中发现可能存在的类似现象提供了一个重要的起点。
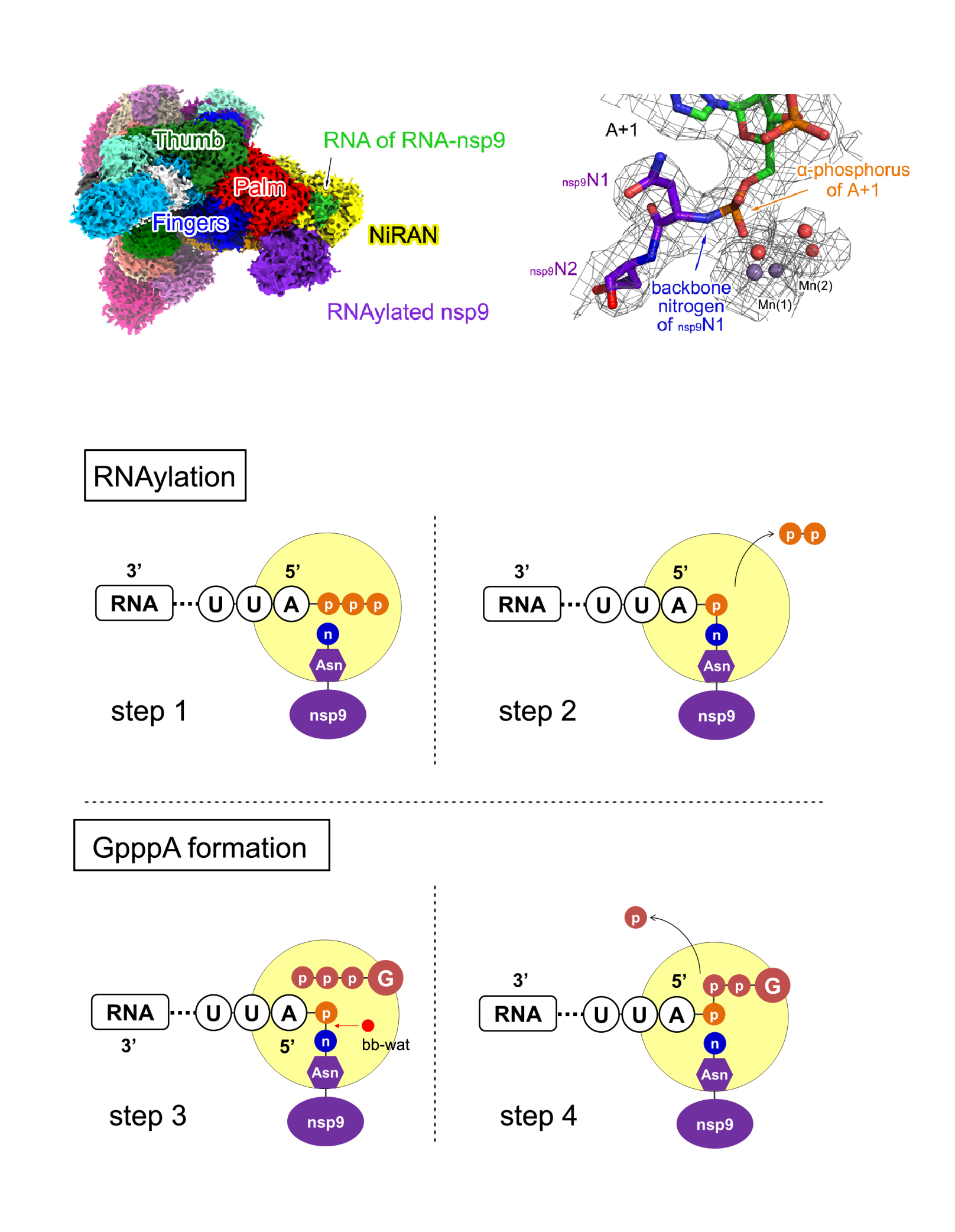
图3 新冠病毒转录复制复合体与RNA-nsp9的复合体结构(上)与加帽新机制(下)
进一步研究发现,核苷类抗病毒药物能够被聚合酶NiRAN结构域,通过类似的机制共价连接到nsp9蛋白,进而阻止了加帽反应过程。尤其特殊的是,当核苷类抗病毒药物索非布韦(sofosbuvir)连接到nsp9蛋白后,药物分子结合在一个称之为“Nuc口袋”的位点,并通过其核糖基团上的化学修饰,诱导NiRAN结构的“S-loop”发生剧烈的构象改变,封闭“G口袋”中GTP分子进出的路径(图4)。这一系列发现不但为理解核苷类抗病毒药物的作用机制提供了全新视角,还展示了一种全新的“induce-and-lock”药物设计策略,为进一步发展高亲和力的新型抗病毒药物提供了一个新颖的角度。
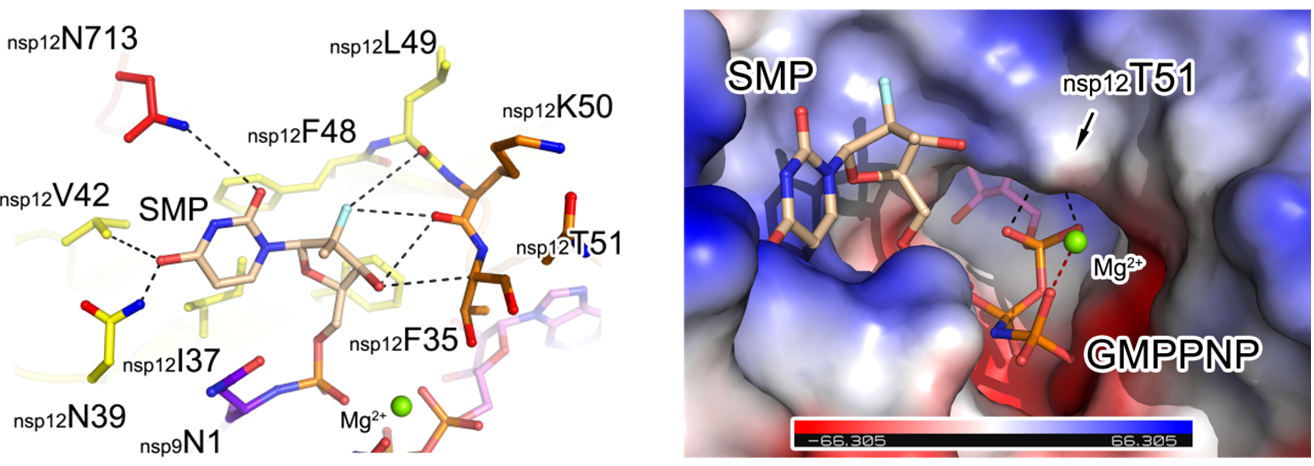
图4 索非布韦与S-loop的作用(左)、S-loop封闭G口袋的机制(右)
该成果的取得得益于研究团队在冠状病毒转录复制领域中长达19年的长期积累。2020年以来,研究团队系统探索了新冠病毒转录复制过程,解析了关键药物靶点蛋白主蛋白酶Mpro和转录复制复合体多个状态三维结构,为认识病毒的生命过程、发展高效抗病毒药物提供了多个关键信息,系列成果先后发表于Nature、Science、Cell和Nature Communications,是国际上新冠病毒转录复制研究中最为系统、引用最多的工作之一,先后入选“2021年度中国科学十大进展”、“2021年度中国生命科学十大进展”和“中国2021年度重要医学进展”等。
清华大学闫利明、黄羽岑、葛基,上科大免化所访问学生刘震宇为共同第一作者。饶子和、娄智勇、高岩为论文共同通讯作者。
原文链接:
Yan, L., et al., A mechanism for SARS-CoV-2 RNA capping and its inhibition by nucleotide analogue inhibitors. Cell, 2022.
https://www.cell.com/cell/fulltext/S0092-8674(22)01256-9



