近日,上海科技大学免疫化学研究所白芳研究员联合复旦大学附属儿科医院李凯主任医师团队,在药理学类期刊Acta Pharmacologica Sinica发表题为“Discovery, evaluation and mechanism study of WDR5-targeted small molecular inhibitors for neuroblastoma”的研究论文,报道了WDR5 WBM位点的新型小分子抑制剂化合物19,并借助x-ray晶体结构解析技术、RNA-seq和多种药理评价实验阐明了其抗神经母细胞瘤的作用机制,并进一步提出与采用靶向WDR5的WBM位点与WIN位点联合用药,协同增强抗肿瘤活性的新策略。该项工作日前也由出版社作为近期亮点文章在其公众号推送:靶向WDR5 WBM位点的神经母细胞瘤抑制剂的发现与机制研究。
神经母细胞瘤是发病率最高的小儿颅外恶性肿瘤(图1 a),高危组患儿的病死率高达50%,其治疗也成为世界性临床难题。针对神经母细胞瘤开发安全有效的分子靶向治疗药物是必要且非常迫切的。近年多项研究表明WD40重复结构域蛋白5(WD40 repeat-containing protein 5,WDR5)参与多种肿瘤的发生与发展,是热门的肿瘤治疗靶点。WDR5在体内主要参与表观遗传调控,同时也是神经母细胞瘤驱动基因MYCN所表达的蛋白质N-myc的辅助因子(图1b)。WDR5与N-myc的相互作用是N-myc促进肿瘤发生的关键。因此,针对WDR5与N-myc等蛋白的结合位点——WBM(WDR5-binding motif)位点开发小分子抑制剂是抗神经母细胞瘤药物开发的新方向。
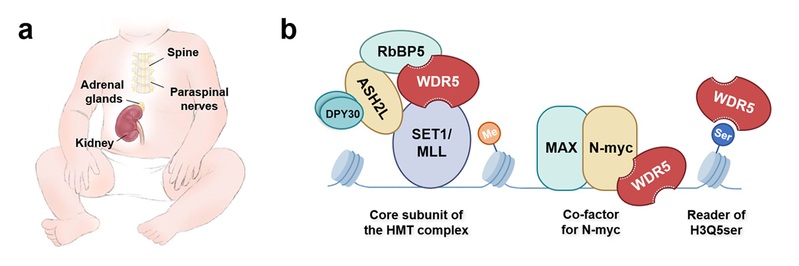
图1 a 神经母细胞瘤的好发部位
b WDR5参与神经母细胞瘤发生和发展的机制
该研究结合计算机辅助虚拟筛选技术与多种生物学活性实验测试,发现了多个与WDR5具有较高亲和力的苗头化合物。其中,苯磺酰基苯并咪唑类小分子——化合物19,对MYCN扩增的神经母细胞瘤细胞系IMR32和LAN5等具有特异性杀伤作用(图2a)。WDR5和化合物19的复合物晶体结构显示,19特异性结合于WBM位点,干扰MYC、KANSL2和RbBP5等蛋白与WDR5的相互作用(图2b),继而阻断神经母细胞瘤中此类蛋白介导的信号调控通路。
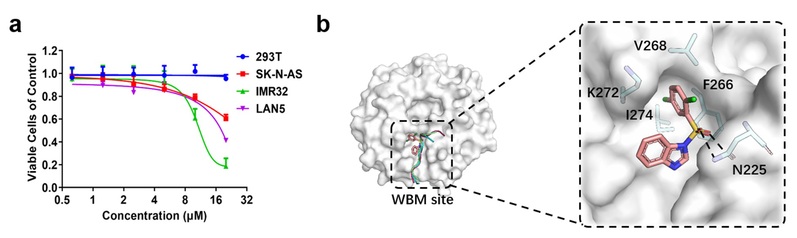
图2
a 化合物19与WDR5的分子亲和活性和对神经母细胞瘤的体外毒性;b 化合物19与WDR5的结合模式。
转录组测序及进一步药理学实验验证发现,化合物19可显著上调MYCN扩增的神经母细胞瘤细胞LAN5中核糖体蛋白的基因转录;激活p53信号,诱导凋亡;抑制DNA复制及细胞周期进程等(图3a)。与WIN位点阻断剂(OICR-9429)相比,化合物19对H3K4三甲基化(H3K4me3)水平的抑制和对p53的激活作用均更强(图3b),表明针对WBM位点开展抗神经母细胞瘤的药物设计更具潜力。
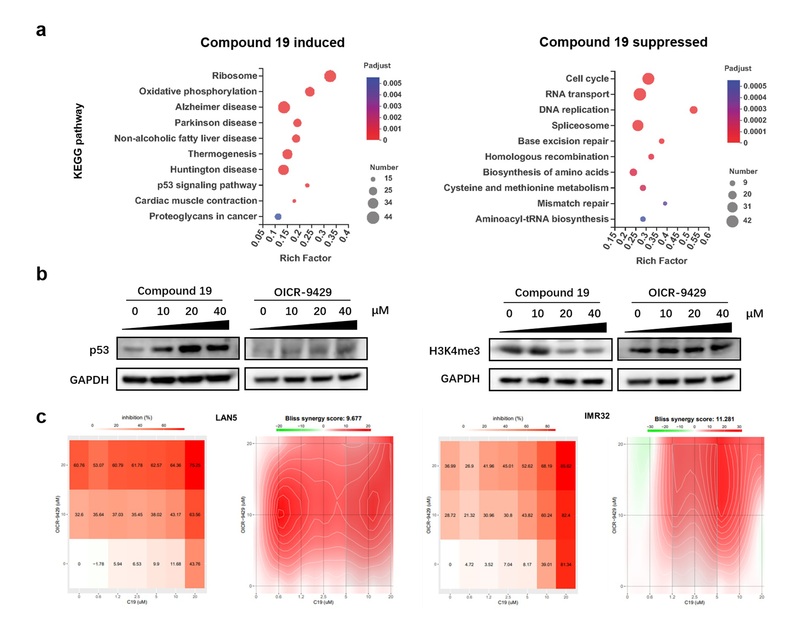
图3
a KEGG通路富集分析化合物19在神经母细胞瘤内的作用机制;b化合物19与OICR-9429对神经母细胞瘤细胞内p53的激活作用和H3K4me3的抑制作用的比较;c Bliss模型分析化合物19与OICR-9429的联用效应。
此外,本研究创新性地联用WBM位点阻断剂(化合物19)和WIN位点阻断剂(OICR-9429)治疗神经母细胞瘤,结果表明两种药物对LAN5和IMR32细胞存在明显的协同杀伤作用(图3c),为靶向WDR5开发新型抗神经母细胞瘤药物及发展联合用药策略提供了理论基础。
复旦大学附属儿科医院韩祺蕾博士和上海科技大学免疫化学研究所博士后张向磊为共同第一作者,李凯主任医师与白芳研究员为共同通讯作者。
本项目得到了国家自然科学基金、上海市科委基金、上海市卫生计生委基金、唐仲英基金会和临港实验室等项目支持。本项目也得到上海科技大学高性能计算平台及免化所药物发现平台等的支持。



