近日,上海科技大学免疫化学研究所杨贝课题组与合作者在国际学术期刊《通讯-生物》(Communications Biology)发表题为 “Antigenic mapping reveals sites of vulnerability on α-HCoV spike protein” 的研究论文,描绘了α属冠状病毒(α-HCoVs)刺突蛋白的抗原图谱,揭示了不同属的人冠状病毒(HCoVs)的刺突蛋白之间在抗原特性上的共性与差异,为开发广谱冠状病毒疫苗提供了理论依据。
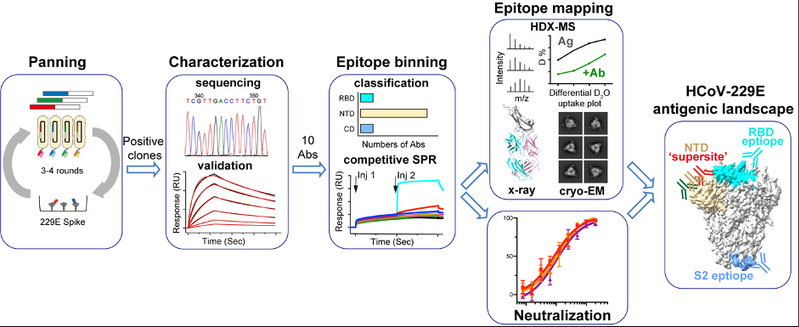
冠状病毒包膜表面的刺突蛋白是介导病毒入侵宿主细胞的重要分子机器,也是抗冠状病毒疫苗设计的关键靶点。目前可感染人的冠状病毒共有7种,分属于α-HCoV和β-HCoV两个属。当前,研发广谱、高效的冠状病毒疫苗是亟待解决的关键科学问题,而对现有7种HCoVs刺突蛋白的抗原特征开展深入研究将有助于探寻在不同HCoVs间均高度保守的抗原表位及基于这些表位研发广谱疫苗。然而,尽管当前人们已对β-HCoVs(尤其是SARS-CoV、SARS-CoV-2和MERS-CoV)刺突蛋白的结构特征和抗原特性进行了详细描述,对α-HCoVs(包括HCoV-229E和HCoV-NL63)刺突蛋白的相关研究却一直处于空白。本研究首先利用组合人源抗体库针对代表性α-HCoV(HCoV-229E)的刺突蛋白筛选并分离了一系列抗体,随后对相关抗体进行了亲和力检测、表位精确鉴定及中和效力分析(图1)。
研究发现HCoV-229E刺突蛋白的N端结构域(NTD)相比于其受体结构域(RBD)和S2亚基具有明显的抗原优势,这一点与之前在β-HCoVs中的观察结果截然相反,在后者中RBD的免疫原性明显优于NTD。此外,研究还发现在HCoV-229E刺突蛋白的NTD中具有一个同时被多个不同中和抗体识别的“抗原超位点”,该位点在目前所有α-HCoVs的分离株序列(包括66株HCoV-229E 和70株HCoV-NL63)中均具有较高保守性,有望作为一个潜在的小广谱(指针对α-HCoVs)抗原表位指导相应的疫苗设计(图2a)。本研究也同时筛选得到了靶向HCoV-229E的RBD与S2亚基的中和抗体。进一步的研究结果表明,RBD靶向抗体的抗原表位处于远离宿主受体hAPN结合位点的另一端,其位置与SARS-CoV-2 RBD中的‘隐蔽表位’高度类似,并且也和靶向SARS-CoV-2‘隐蔽表位’的中和抗体一样,通过诱导刺突蛋白的解聚来发挥其中和效应(图2b)。而靶向S2亚基的中和抗体F12则特异性识别位于连接结构域(Connector Domain, CD)的结构表位,它也是第一株靶向α-HCoVs S2亚基的中和抗体。位于S2亚基的抗原表位因其更高的种间保守性一直以来都受到疫苗研发领域的较多关注,本研究因此也对目前已发现的S2亚基抗原表位进行了系统的比较与梳理(图2c)。结果表明,S2亚基中的Stem helix区域比CD区域具有更高的广谱中和潜力,但其较低的免疫原性也对靶向性疫苗设计提出了更高要求。
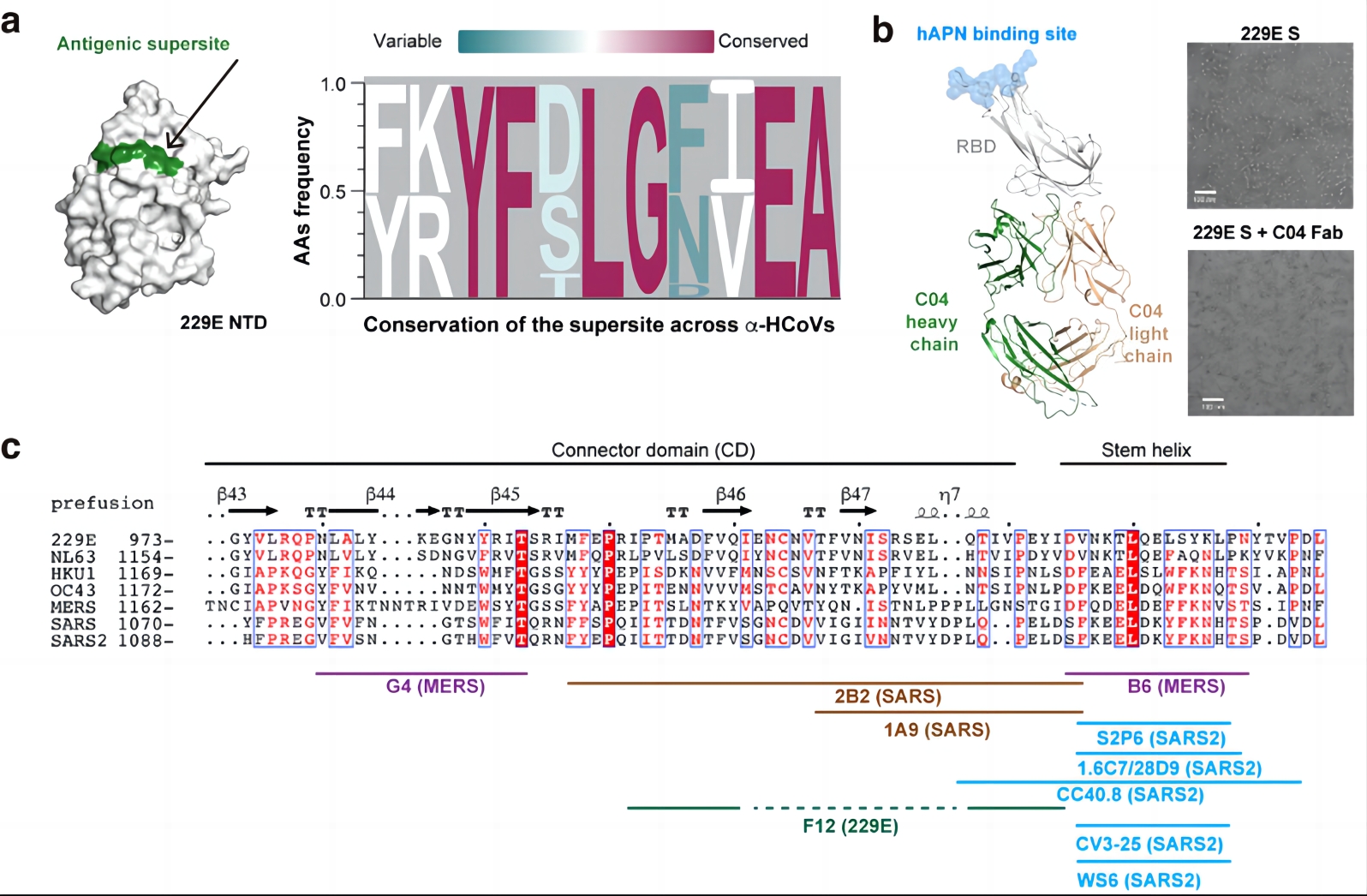
图2a. 位于HCoV-229E NTD的“抗原超位点”
在α-HCoVs中具有较高保守性
图2b. 靶向HCoV-229E RBD受体结合位点远端的C04抗体
通过诱导刺突蛋白的解聚来发挥中和效应
上海科技大学免疫化学研究所/生命科学与技术学院2022届博士毕业生项江超、原免化所工程师苏洁与复旦大学基础医学院研究生蓝巧帅为本文的共同第一作者。上科大免化所和生命学院双聘助理教授杨贝、加拿大滑铁卢大学Anvil研究所Shane Miersch博士、复旦大学基础医学院教授陆路为本文的共同通讯作者。上科大为第一完成单位。



