近日,上海科技大学免疫化学研究所Roger Kornberg/张贺桥研究团队(结构生物化学课题组)在国际学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of the Sciences, PNAS)上发表研究论文,报道了真核生物组蛋白乙酰转移酶NuA4复合物近原子分辨率冷冻电镜结构。

不同于原核生物,真核生物遗传物质的基本组成单位是核小体(nucleosome)而不是裸露DNA。核小体由147 bp DNA缠绕在组蛋白八聚体(包括H2A、H2B、H3和H4)上约1.7圈而形成。针对组蛋白H3和H4氨基端尾巴的修饰研究一直是表观遗传领域的核心内容。其中,组蛋白乙酰化修饰是最普遍的一种表观遗传修饰,主要由组蛋白乙酰转移酶SAGA和NuA4复合物来完成。研究表明SAGA主要对组蛋白H3进行乙酰化修饰,而NuA4则主要对H2A和H4进行乙酰化修饰。NuA4的乙酰转移酶活性对于真核生物维持基因组稳定性以及转录调控具有重要作用。酿酒酵母NuA4是一个由13个亚基组成的、分子量超过1 MDa的超级复合物。尽管NuA4的生化研究已经足够详细,但是NuA4高分辨率结构信息仍然是缺失的。
免化所结构生物化学课题组持续关注真核生物转录调控。实验室Co-PI张贺桥等人于2021年首次解析了真核生物转录调控核心复合物-中介体(Mediator)冷冻电镜结构,并发表于国际知名学术期刊Molecular Cell(Zhang et al., Mol Cell 2021)上。
在最近的一项工作中,该团队成功纯化得到了酿酒酵母内源NuA4复合物样品,并进行了大量的冷冻电镜条件摸索,最后成功解析了3.8-4.0 Å NuA4复合物冷冻电镜结构。该结构显示:NuA4复合物的Eaf1和Eaf2亚基共同组成了该复合物的结构框架,其它亚基则主要围绕Eaf1和Eaf2组装(图1)。不同于以往的研究,该研究发现NuA4的“脖颈”区域主要由Eaf1、Eaf2和Epl1的氨基端形成的“三明治”结构组成。另外,结合本文报道的冷冻电镜结构和AlphaFold-Multimer预测结构,作者还预测了催化模块以及具有识别乙酰化组蛋白功能的Yaf9亚基的位置。有意思的是,该工作生化部分结果显示NuA4催化模块与完整NuA4复合物几乎具有同等的乙酰转移酶活性。凝胶阻滞和密度梯度离心实验结果显示NuA4与核小体组相互作用较弱,而催化模块却可以与核小体直接结合,作者据此提出了NuA4其它调控亚基可能参与负调控NuA4与核小体相互作用的可能性。
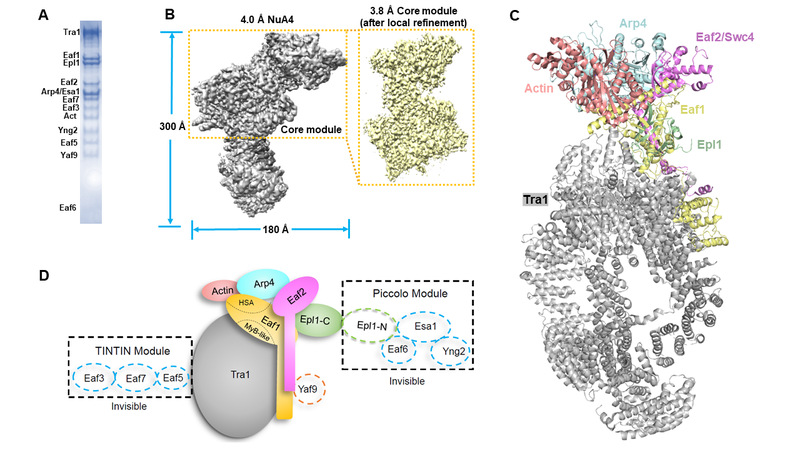
图1. NuA4复合物纯化及冷冻电镜结构
(A)酿酒酵母完整NuA4复合物纯化结果;(B)NuA4冷冻电镜重构图;(C)NuA4冷冻电镜结构;(D)NuA4亚基组成及位置示意图(电镜中未观察的部分以虚线框表示)
免化所结构生物化学课题组2019级博士研究生纪莉婷、高级工程师赵莉霞、2020级博士研究生许可为本论文共同第一作者。结构生物化学课题组负责人Roger Kornberg教授及张贺桥副研究员为本论文共同通讯作者。上海科技大学为第一完成单位。其他参与作者包括结构生物化学课题组2021级硕士研究生高荟菡及2020级硕士研究生周阳。电镜数据收集工作在上海科技大学生物电镜平台完成。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2214313119



