2023年5月26日,上海科技大学免疫化学研究所特聘教授、清华大学教授饶子和院士,免化所副研究员高岩联合南开大学生命科学学院教授贡红日,广州实验室副研究员刘凤江等合作者在Molecular Cell在线发表题为“Structure of the human ATP synthase”的研究论文,在国际上率先报道了人源ATP合酶四种构象的高分辨率电镜结构,为其功能机制及相关疾病的理解和靶向药物的开发奠定了重要基础。
细胞呼吸是生物体重要的代谢活动,为生命活动提供了直接的能量物质三磷酸腺苷(ATP),其中线粒体氧化磷酸化(oxidative phosphorylation, OXPHOS)系统是处于细胞代谢的中枢位置,包括五个酶复合物(线粒体呼吸链复合物Ⅰ- IV和ATP合成酶)和两个移动的电子载体(细胞色素c和泛醌)。复合物Ⅰ和复合物Ⅱ分别氧化NADH和琥珀酸,同时将电子传递给泛醌形成氢醌;氢醌被复合物Ⅲ氧化生成泛醌,同时将电子传递给细胞色素c,最后电子传递给结合在复合物Ⅳ中的氧气分子并还原生成水分子。电子在呼吸链传递过程中,伴随复合物Ⅰ、Ⅲ和Ⅳ将质子从线粒体基质转移到线粒体膜间隙,产生的跨膜质子梯度驱动ATP合酶(亦称为复合物Ⅴ)生成ATP。氧化磷酸化系统损伤包括其组分发生突变会引起一系列生理功能紊乱和代谢相关的疾病。研究线粒体氧化磷酸化系统膜蛋白复合物组成、组装、结构,对于理解呼吸链电子传递机制、氧化还原偶联质子跨膜梯度形成机制、氧化磷酸化系统功能异常与机体疾病间联系、药物开发等都具有重要意义。
ATP合成酶也被称为F1Fo-ATP合成酶、F型ATP合成酶、旋转分子马达等。作为氧化磷酸化系统反应的最后一步,它利用电子传递链氧化还原反应过程中产生的质子动力势能(proton motive force, PMF)成为了细胞提供了最主要的ATP来源。ATP合成酶的反应机制多年来一直是学术界研究的热点:Peter Mitchell凭借化学渗透假说独得1978年诺贝尔化学奖;Paul D. Boyer和John Walker因阐明ATP合成酶的催化机制而获得1997年诺贝尔化学奖。然而,在几十年的研究岁月中,受到材料获取、纯化条件等因素的限制,人源线粒体ATP合成酶的结构至今仍未被解析,这限制了对其功能的进一步理解和利用。在该研究中,研究人员通过大量摸索人源ATP合成酶提取纯化条件最终获取了均一、稳定、有活性的人源ATP合成酶。接着,研究人员利用冷冻电镜技术解析了人源ATP合成酶的四种构象的高分辨结构,从而进一步推进了对ATP合成酶结构和功能的认识。ATP合成酶类似于旋转分子马达,由“定子”和“转子”组成,其中“转子”部分包含γεδc亚基。在PMF的推动下,c亚基旋转并带动γεδ亚基一起转动,伴随αβ亚基构象改变进而催化ATP的生成。在某些情况下,ATP合成酶也可以水解ATP,此时c亚基将反向旋转,发挥离子泵功能,将质子运输到膜外。
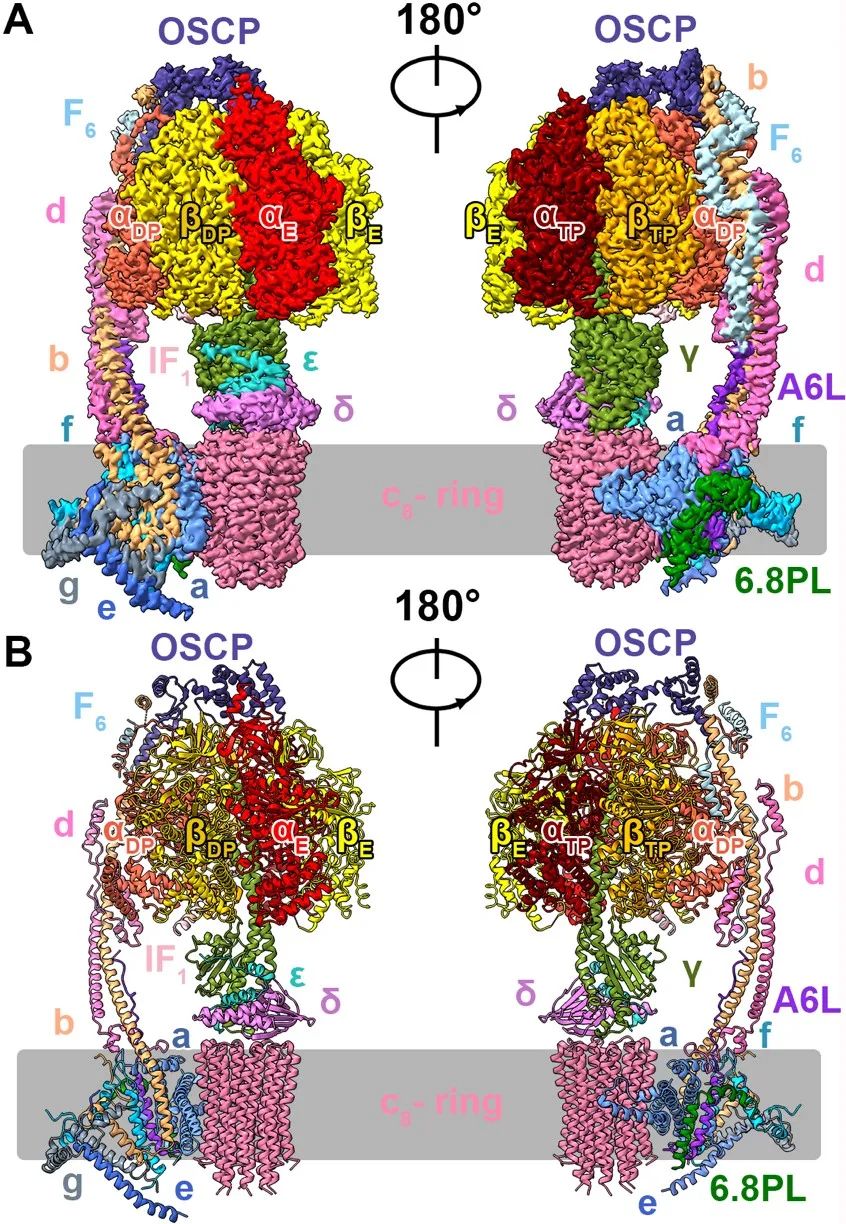
人源ATP合成酶的三维结构
该研究解析了人源ATP四种旋转构象结构,除了传统的三种构象外,还发现了亚中间状态state 3b。在四种旋转状态中,β亚基表现出显著的构象变化,通过结构信息推测ATP水解过程中ADP释放发生在β亚基转化为开放构象之后,这一发现进一步推进了对ATP合成酶合成/水解ATP过程中旋转催化机制的认识。
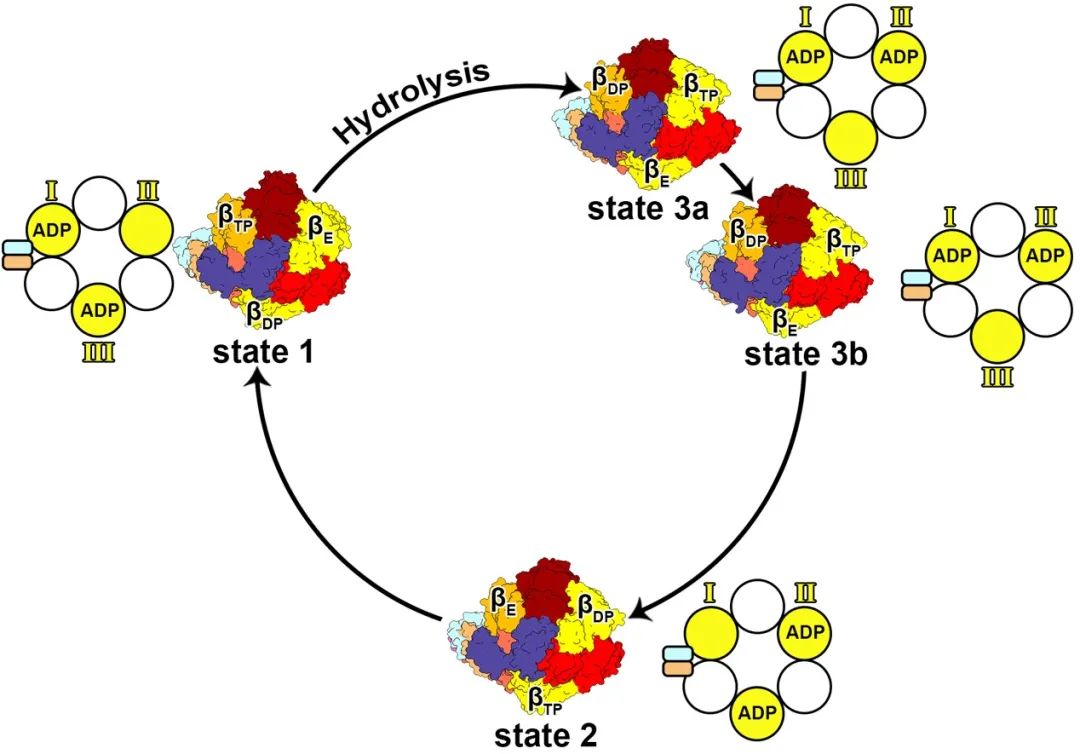
人源ATP合成酶的四种构象顶视图
得益于高分辨率,ATP合成酶质子进出通道的水分子密度清晰可见,进一步夯实完善了ATP合成酶运转过程中质子进出的分子机制。此外,研究人员同时分析了相关临床突变致病的分子作用机制,发现报道的突变体多出现在亚基之间的接触面上,影响了复合物结构的稳定性,为疾病的理解和治疗提供了新的见解。
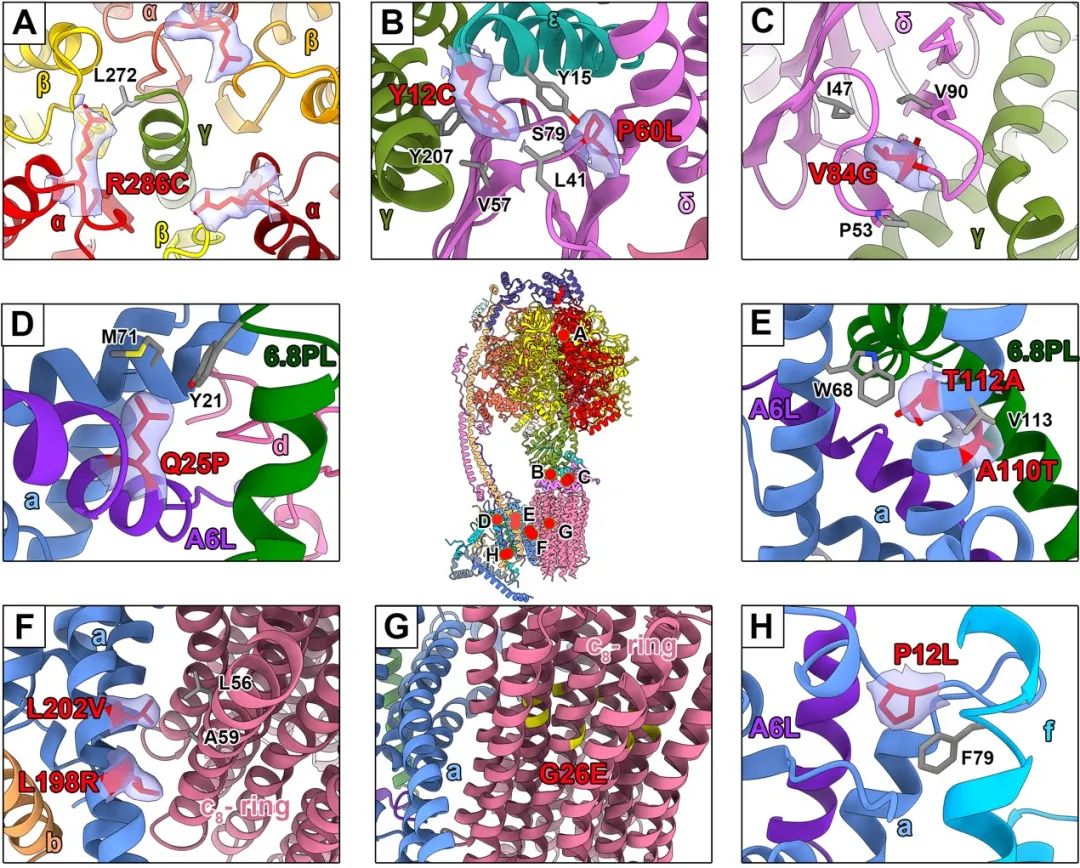
人源ATP合成酶相关的临床突变位点分析
值得一提的是,ATP合成酶作为ATP的主要能量来源,在原核生物和真核生物中都发挥着不可替代的作用,是热门的药物开发靶点。以人类结核病为例,靶向结核分枝杆菌ATP合成酶的药物贝达喹啉(bedaquiline,BDQ)是四十年来FDA批准的第一个抗结核新药,也是当前世界卫生组织推荐的治疗耐多药结核病长程治疗的首选方案,已在全球120多个国家推广使用。此外,研究发现一些癌症和癌细胞亚群依赖于线粒体氧化磷酸化来满足生物能量和生物合成需求。最新研究也已证实,糖基化大环内酯类药物可以通过靶向抑制ATP合成酶用于白血病的治疗。因而,人源ATP合成酶结构的解析将为开发靶向性更好、副作用更低的抗感染药物以及抗肿瘤药物奠定基础。
南开大学博士研究生赖越峥、张玉莹、周珊、徐金旭和杜占强为本文的共同第一作者。南开大学生命科学学院研究员贡红日,上海科技大学免疫化学研究所特聘教授饶子和院士、副研究员高岩,广州实验室副研究员刘凤江为共同通讯作者。该工作得到了国家重点研发计划青年科学家项目、国家自然科学基金委优秀青年科学基金的资助。上海科技大学生物电镜平台和广州实验室影像成像子平台提供了重要的技术支持。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00324-6



