2023年7月17日,上海科技大学免疫化学研究所特聘教授Roger Kornberg/Co-PI副研究员张贺桥研究团队(结构生物化学课题组)在学术期刊《美国国家科学院院刊》(PNAS)上在线发表了题为“Class I histone deacetylase complex: structure and functional correlates”的研究论文,报道了真核生物I类组蛋白去乙酰化酶Clr6-HDAC复合物3.2 Å冷冻电镜结构。

真核生物遗传物质的基本组成单位是核小体(nucleosome)。核小体由147 bp DNA缠绕于组蛋白八聚体(由H2A、H2B、H3和H4组成)上约1.75圈形成,组蛋白H3和H4氨基端尾巴会发生包括甲基化、乙酰化、泛素化、磷酸化等在内的多种修饰。这些表观遗传修饰通常是可逆的,如组蛋白H3和H4氨基端特定赖氨酸位点的乙酰化修饰由组蛋白乙酰转移酶完成,而细胞核内的组蛋白去乙酰化酶(histone deacetylase, HDAC)则可以将这些乙酰化修饰去除。真核生物乙酰化水平受到精密调控,乙酰化水平的异常会导致多种疾病甚至癌症的发生。其中,酿酒酵母I类组蛋白去乙酰化酶复合物Rpd3S及其裂殖酵母同源蛋白Clr6S是锌离子依赖的组蛋白去乙酰化酶,其功能最广谱、研究也最为广泛。已有研究表明Clr6S包含六个亚基:Clr6、Pst2、Prw1、Alp13、Cph1及Cph2,分子量达到400 kDa。Rpd3S/Clr6S尽管已发现近20年,但其结构信息仍然缺失。
免化所结构生物化学课题组持续关注表观遗传修饰及真核生物转录调控。此前课题组张贺桥和副研究员聂焱等人解析了真核生物转录调控核心复合物-中介体(Mediator complex)冷冻电镜结构(Zhang et al., Mol Cell, 2021)。Roger Kornberg/张贺桥团队报道了组蛋白乙酰转移酶NuA4复合物冷冻电镜结构(Ji et al., PNAS, 2022)。这些研究为本工作的发表提供了研究基础。
在该工作中,课题组2022级博士研究生王晓及高级工程师王雁南利用昆虫表达系统成功重组表达并纯化了纯度高、均一性好的Rpd3S及Clr6S两种复合物,建立了体外去乙酰化酶活性检测体系,并利用单颗粒冷冻电镜重构技术成功解析了3.2 Å Clr6S复合物结构。出乎意料的是其中包含两个具有MRG结构域的Alp13亚基。结构分析表明Pst2及Cph2亚基构成了复合物组装的核心骨架。与之前生化研究一致的是,Clr6、Pst2、Prw1组成了一个稳定的核心复合物,其中催化亚基Clr6被Pst2及Cph2包围在复合物核心位置,方便其进行后续去乙酰化反应。由于结构中核心催化区域分辨率更高,该研究同时鉴定出了直接参与催化反应的关键锌离子、作为亲核试剂的水分子以及关键催化氨基酸。有意思的是,来自Pst2的一个loop环横置在催化亚基Clr6活性中心附近,而删除这个loop环后会导致Clr6S的HDAC活性降低。据此,团队提出了该loop环(被命名为“active center loop”)可能会帮助底物结合、从而提高催化效率的机制。在该研究中,团队同时研究了Clr6S/Rpd3S与核小体底物的结合模式。电镜结构显示核小体结合于Clr6S/Rpd3S的凹面。Clr6S/Rpd3S与核小体有多个结合界面,以方便核小体进行后续的去乙酰化反应。
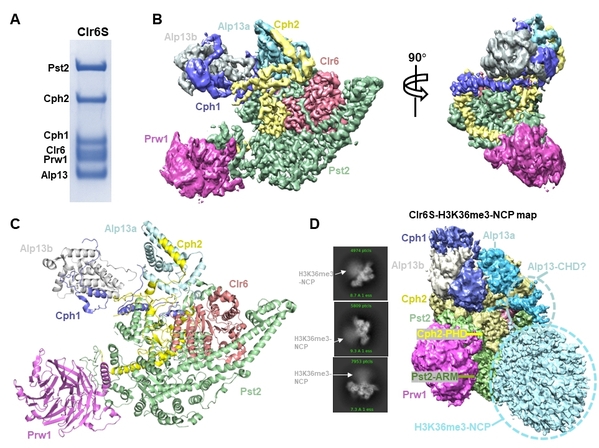
图1. I类组蛋白去乙酰化酶Clr6 HDAC (Clr6S) 复合物纯化及冷冻电镜结构
(A) Clr6S复合物纯化结果;(B) Clr6S冷冻电镜重构图;(C) Clr6S冷冻电镜结构;(D) Clr6S与H3K36me3修饰的核小体复合物冷冻电镜重构图
王晓和王雁南为该论文共同第一作者,结构生物化学课题组张贺桥、Roger Kornberg为本论文共同通讯作者。上海科技大学为第一完成单位。
论文链接:https://www.pnas.org/doi/epdf/10.1073/pnas.2307598120



