近日,上海科技大学免疫化学研究所刘佳课题组与中南大学生命科学学院医学遗传学中心芙蓉实验室李家大课题组合作,利用团队自己设计和构建的膜蛋白组CRISPR/sgRNA文库首次鉴定了杆状病毒AcMNPV转导哺乳动物系统的重要宿主因子EXTL3和NPC1,揭示了EXTL3和NPC1在杆状病毒粘附、进入及内体逃逸过程中的功能。该研究成果以“EXTL3 and NPC1 are mammalian host factors for Autographa californica multiple nucleopolyhedrovirus infection”为题,于9月4日在Nature Communications上在线发表。
杆状病毒作为载体转导外源基因进入昆虫细胞的蛋白表达系统在实验室和工业界都有广泛应用。除了转导基因进入昆虫细胞,杆状病毒也作为转导载体在哺乳动物系统中应用。由于杆状病毒具有较大的包装能力以及在哺乳动物体内不复制、不整合的特性,因此杆状病毒被认为是一种极具发展前景的基因治疗载体。已有的研究表明杆状病毒可与一系列基因编辑工具胞内递送适配,包括传统的锌指核酸酶(ZFNs)、转录激活因子样效应物核酸酶(TALENs),以及新型的成簇规律间隔短回文重复序列相关核酸酶(CRISPR-Cas)、基于CRISPR的引导编辑器(CRISPR-based prime editors)等。更重要的是,杆状病毒已被用于哺乳动物体内的基因递送。尽管被广泛应用,但杆状病毒在哺乳动物细胞中的转导机制尚不清楚,目前还没有对哺乳动物细胞中杆状病毒宿主因子的系统研究。
本研究中,研究人员利用膜蛋白组CRISPR/sgRNA文库(SfCRISPR)对带有EGFP序列的重组杆状病毒Bac-EGFP进行两轮阴性筛选,确定了包括外泌素样糖基转移酶3(EXTL3)和NPC细胞内胆固醇转运蛋白1(NPC1)在内的几种杆状病毒候选宿主因子。通过机制研究发现,EXTL3参与硫酸乙酰肝素的生物合成从而介导杆状病毒的粘附和进入过程,NPC1则是介导杆状病毒与宿主的膜融合过程以及后续的内体逃逸过程。在体内实验中,研究人员发现敲低Npc1基因的表达可以显著降低杆状病毒在小鼠肝脏中的转导效率。该研究首次系统鉴定了杆状病毒在哺乳动物细胞中的重要宿主因子,对其应用提供了理论依据。
中南大学生命科学学院医学遗传学中心芙蓉实验室博士研究生黄悦戈和上海科技大学免疫化学研究所梅红助理研究员为本文的共同第一作者。上海科技大学免疫化学研究所刘佳研究员、梅红助理研究员和中南大学生命科学学院医学遗传学中心芙蓉实验室李家大教授为共同通讯作者。上海科技大学免疫化学研究所Roger Kornberg课题组副研究员聂焱,以及生物医学大数据平台工程师王玮也提供了帮助。该项目得到了上海市科学技术委员会项目、上海市生物大分子与精准医药前沿科学研究基地以及中南大学研究生科研创新项目的支持。
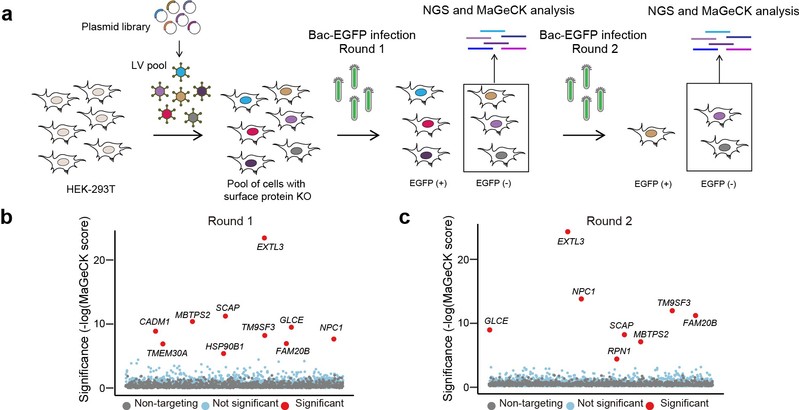
图1. 运用SfCRISPR对Bac-EGFP宿主因子进行阴性筛选流程图。
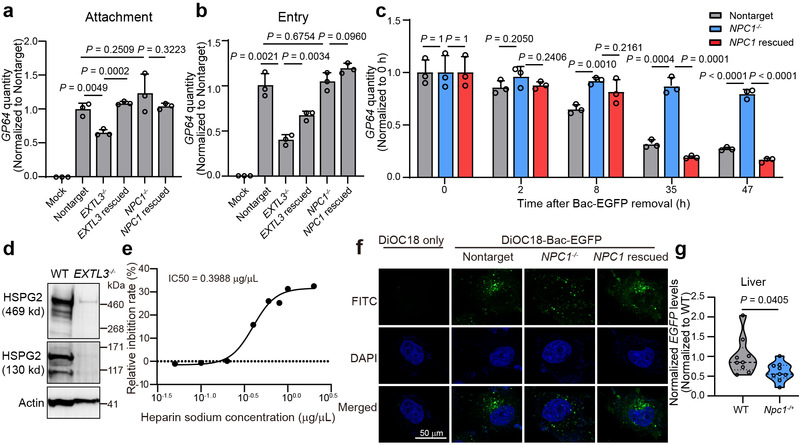
图2. EXTL3和NPC1介导杆状病毒转导哺乳动物细胞的机制研究图。
文章链接:https://doi.org/10.1038/s41467-024-52193-w



