4月22日,上海科技大学联合中国科学院上海药物研究所、清华大学、中国科学院武汉病毒研究所和重庆医科大学等多家单位在《自然》(Nature)上共同发表了题为“Substrate recognition and cleavage mechanism of the monkeypox protease, Core protease”的最新研究成果。联合攻关团队首次证实天花病毒、猴痘病毒等正痘病毒属的核心蛋白酶(Core Protease,CorePro)是一个全新的广谱抗病毒药物靶标;解析了猴痘病毒核心蛋白酶的高分辨率三维空间结构,揭示了其识别底物的分子机制;在此基础上,研究团队成功设计了多个具有强效广谱抗病毒活性的小分子抑制剂并阐明其精确作用机制。该系统性研究为广谱抗正痘病毒(如猴痘病毒)药物的开发奠定了重要基础。上海科技大学为第一完成单位。
正痘病毒属包含天花病毒、猴痘病毒等重要的人类病毒,它们是一类有包膜的双链DNA病毒。天花病毒引发的天花曾经是人类历史上极具毁灭性的传染病之一,据不完全统计,曾导致数亿人死亡。猴痘病毒(mpox virus, MPXV)于1958年首次在实验猴群中被分离鉴定,1970年报道了首例人感染病例。猴痘病毒感染后的典型症状包括高热、持续性头痛、特征性淋巴结肿大以及渐进性皮肤损伤等,严重时可引发脑炎、败血症、永久性视力丧失甚至死亡。2022年5月非流行区爆发疫情以来,猴痘病毒确诊病例数呈指数级增长。世界卫生组织(WHO)分别于2022年7月23日和2024年8月15日两次启动最高级别警报,将猴痘疫情列为国际关注的突发公共卫生事件(PHEIC)。截至最新统计,131个国家和地区累计报告超过13.4万例实验室确诊病例,其中死亡291例。目前针对猴痘病毒感染的预防和治疗手段非常有限。因此,发现和确证抗正痘病毒的新型药物靶点,以及开发强效抗病毒抑制剂,对当前猴痘疫情的有效控制具有现实紧迫性,同时为应对其他正痘病毒的威胁提供保障。
正痘病毒属的成员都编码一种高度保守的核心蛋白酶(在痘苗病毒和猴痘病毒中称为I7,在天花病毒中称为K7),这种蛋白酶对于病毒成熟和感染性子代病毒的产生至关重要。核心蛋白酶能够精准识别Ala-Gly-Xaa序列并在甘氨酸(Gly)位点酰胺键位置进行切割,驱动病毒粒子从不具有感染性的未成熟病毒形态(IV)转变为具有感染性的成熟病毒形态(IMV)。核心蛋白酶的突变或缺失会导致病毒失去感染能力,提示猴痘病毒核心蛋白酶是一个潜在的抗病毒药物开发靶标。
研究团队成功表达并纯化了具有活性的猴痘病毒核心蛋白酶,结合单颗粒冷冻电镜和X射线晶体衍射技术,解析了其高分辨率的三维结构(图1)。核心蛋白酶呈现出二体的组装模式,每个单体包括N端结构域(N-terminal domain, NTD),催化结构域(catalytic domain, CD)和C端结构域(C-terminal domain, CTD)。活性中心位于催化结构域,包含一个催化三联体Cys328-His241-Asp258。猴痘病毒核心蛋白酶的二体相互作用模式与其他重要人类病毒的蛋白酶不同,是核心蛋白酶结构稳定和发挥催化功能的关键。
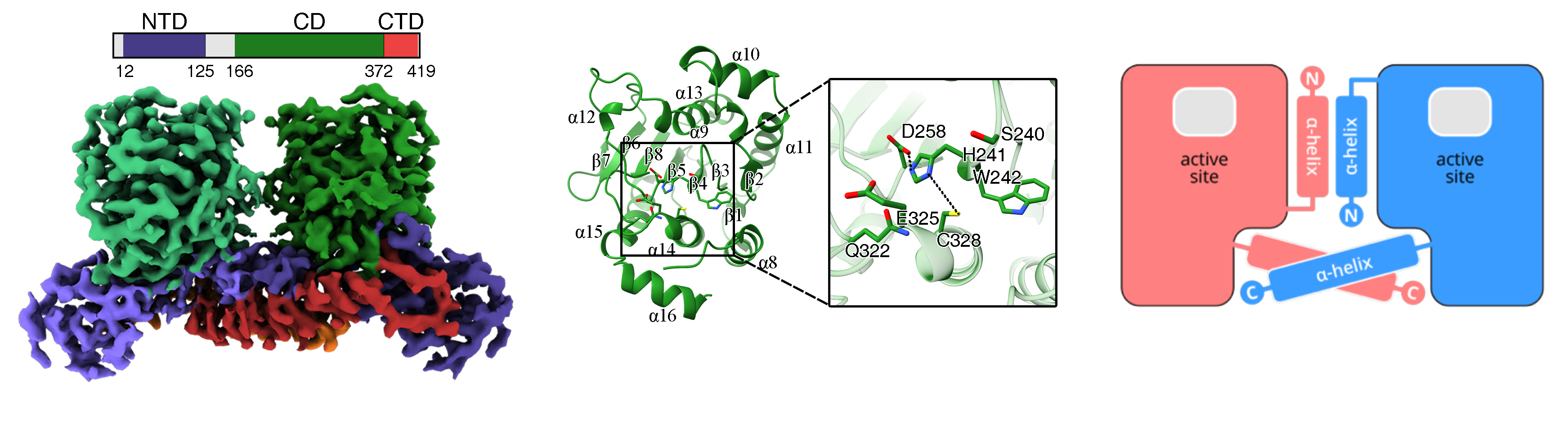
图1 猴痘病毒核心蛋白酶的整体结构、催化结构域特征及二聚化模式
为了开发潜在的靶向猴痘病毒核心蛋白酶的抑制剂,研究团队首先采用高通量筛选的方法,发现一种用于治疗肌肉萎缩的广谱半胱氨酸蛋白酶抑制剂aloxistatin (E64d)对其催化活性具有较好的抑制效果,同时也表现出一定的抗痘苗病毒及抗猴痘病毒活性,表明aloxistatin能够作为开发抗痘病毒药物的苗头化合物。团队随后解析了猴痘病毒核心蛋白酶与aloxistatin复合物的结构,发现aloxistatin与活性中心附近一个非催化的Cys237残基形成共价键,但未能完全占据底物结合口袋,这可能是其抑制活性不强原因。
因此,为了开发更强效的新型靶向抑制剂,研究团队开展了病毒核心蛋白酶底物识别和催化机制的研究。研究人员以核心蛋白酶一种天然底物P25K的序列为基础,设计了一段C末端醛基取代的底物类似物I-G18。I-G18能够与核心蛋白酶的催化中心的Cys328共价结合,模拟催化中间态的结构特征。研究团队通过冷冻电镜技术,解析了这一复合物的三维结构(图2)。发现在底物的诱导下,核心蛋白酶活性中心发生一系列构象变化,在S1和S2位形成特征的狭长口袋,仅可容纳P1位Gly和P2位Ala这两个侧链极短的氨基酸,解释了核心蛋白酶对底物中这两个位置氨基酸的高度选择性。

图2 猴痘病毒核心蛋白酶的底物识别机制
以核心蛋白酶的底物识别机制为基础,研究团队设计合成了一系列拟肽类抑制剂,其中A3-A6具有高效的病毒核心蛋白酶抑制活性(IC50范围:44.9 nM~100.3 nM),且表现出较强的抗猴痘病毒活性(EC50范围:1.98 μM~7.31 μM)和抗痘苗病毒活性(EC50范围:1.39 μM~3.66 μM),同时具有良好的安全性(CC50大于200 μM)。研究人员解析了抑制剂A3与核心蛋白酶的复合物结构,他们发现A3不仅可以与蛋白酶的催化中心的Cys328形成共价键,还可以利用其化学修饰基团同底物结合口袋的氨基酸残基形成额外的氢键相互作用,以增强其结合能力。这些研究结果表明了化合物A3-A6在后续开发广谱抗痘病毒抑制剂上的具有巨大潜力,是良好的先导化合物。
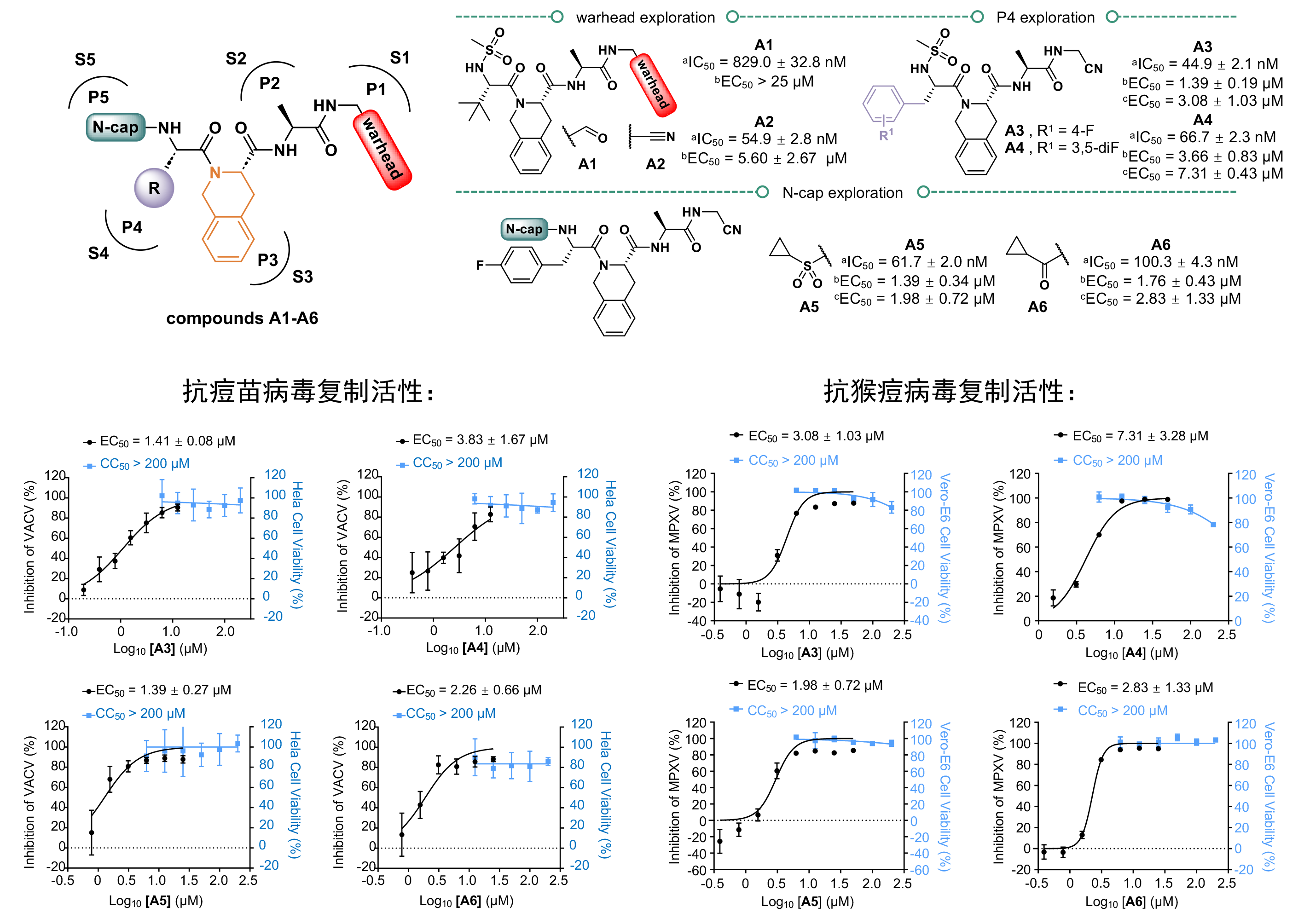
图3 靶向抑制剂的设计策略与构效关系
(a抗猴痘病毒核心蛋白酶活性;b抗痘苗病毒复制活性;c抗猴痘病毒复制活性)
本研究工作是抗痘病毒药物研究领域的重大突破,首次明确了核心蛋白酶的组装模式及底物识别机制,并基于该发现成功设计并筛选出一系列新型拟肽类化合物,这些化合物不仅表现出优异的酶活抑制效果,更展现出显著的广谱抗痘病毒活性。这些研究成果一方面为当前猴痘病毒的防治提供了全新的科学依据和潜在治疗手段,另一方面为应对未来可能由正痘病毒属引发的公共卫生安全威胁储备了前瞻性解决方案,具有广阔的应用前景。
原文链接:https://www.nature.com/articles/s41586-025-09014-x



