近日,上海科技大学免疫化学研究所李俊/清华大学饶子和等团队在《自然-通讯》(Nature Communications)在线发表了题为“Structure and mechanism of a mycobacterial isoniazid efflux pump MsRv1273c/72c with a degenerate nucleotide-binding site”的研究论文,在国际上率先发现并鉴定分枝杆菌异源二体型ABC转运体MsRv1273c/72c是一线抗结核药物异烟肼的外排泵,且参与了病原体对该药物的天然耐受,还揭示了一种由退化型ATP结合位点和不对称构象介导的底物转运新机制。这一研究不仅阐明了一种结核病耐药的关键途径,更重要的是为结核病治疗提供了新的药物靶标,对开发新型抗结核药物和解决全球结核病耐药性问题具有重要科学意义和临床研究价值。
结核病是当今世界上严重威胁人类生命健康的重大传染性疾病,由病原体结核分枝杆菌感染引起。当前抗结核治疗手段非常有限,主要依靠异烟肼、利福平、乙胺丁醇、吡嗪酰胺等一线抗结核药物联合用药进行治疗。但结核耐药问题始终无法克服,还面临日益加重的严峻形势,给结核病防治带来了极大的挑战。除了药物靶点突变引起耐药以外,药物外排泵(包括ABC家族转运体)是导致耐药的重要原因之一。然而,结核病药物外排泵的发现多为间接证据,尤其缺少分子层面的直接证据。
研究人员针对结核分枝杆菌的ABC家族转运体Rv1273c/72c及其耻垢杆菌同源蛋白展开了研究,证明MsRv1273c和MsRv1272c形成异源二体形式的完整转运体,并且含有一个退化型的ATP结合位点。接着,研究人员通过体外脂质体转运实验和质谱分析首次从分子水平证明该转运体是一个异烟肼药物外排泵并且具有浓度依赖关系,进一步通过敲除回补和细菌生长实验证明MsRv1273c/72c的存在确实降低了分枝杆菌对异烟肼的敏感性,导致了细菌对异烟肼耐药。
研究人员利用冷冻电镜解析了MsRv1273c/72c处于不同状态下的一系列结构,发现该异源二体转运体存在不对称性,特别是在MsRv1272c中多出了额外的N端extending loop和胞外侧helical hairpin结构,可能用于帮助底物进入跨膜区的中央空腔和从中央空腔释放至周质侧。本研究首次捕获到了三种不对称型构象,这些构象从未在其他类似的异源二体ABC转运体的研究工作被报道。结构分析表明,其胞内可溶区的核苷酸结合结构域(NBD)均呈现部分二聚化,两个NBD只在退化型ATP结合位点处关闭,而在另一个正常的ATP结合位点处则不同程度打开。由此,这些构象代表了转运体处于两个NBD打开(中央空腔向内开口状态)和完全关闭(中央空腔内外同时闭合或者向外开口状态)之间的中间状态。这些中间态是状态转换所必须的,其中,MsRv1272c的NBD中的D-WalkerB loop和X-signature loop通过构象变化可影响ATP在两个核苷酸结合位点的结合。该转运体通过NBD在退化型ATP结合位点的部分二聚化,来调控和协调两个ATP结合位点的功能活性,进而介导了整个底物转运过程。
综上,本研究揭示了MsRv1273c/72c的由退化型ATP结合位点和不对称构象介导的一种底物转运新机制,这与同源二体型ABC转运体(含有两个正常活性的ATP结合位点)显著不同,为深入理解其他含有退化型ATP结合位点的异源二体ABC转运体(比如,半数的人源异源二体ABC转运体都含有退化型ATP结合位点)提供了重要参考和启示,增加了对ABC转运体家族结构和机制多样性的认识。
Rv1273c/72c有望成为一个有价值的药物新靶点,通过开发靶向抑制剂并与异烟肼的联合使用来提高异烟肼的治疗效果,从而降低异烟肼耐药的发生率。MsRv1273c/72c作为一个新发现的异烟肼药物外排泵,为研究和解决异烟肼耐药问题提供了新的思路。
上海科技大学博士毕业生于菁和博士生兰宇辉为本文共同第一作者,上海科技大学为第一完成单位。
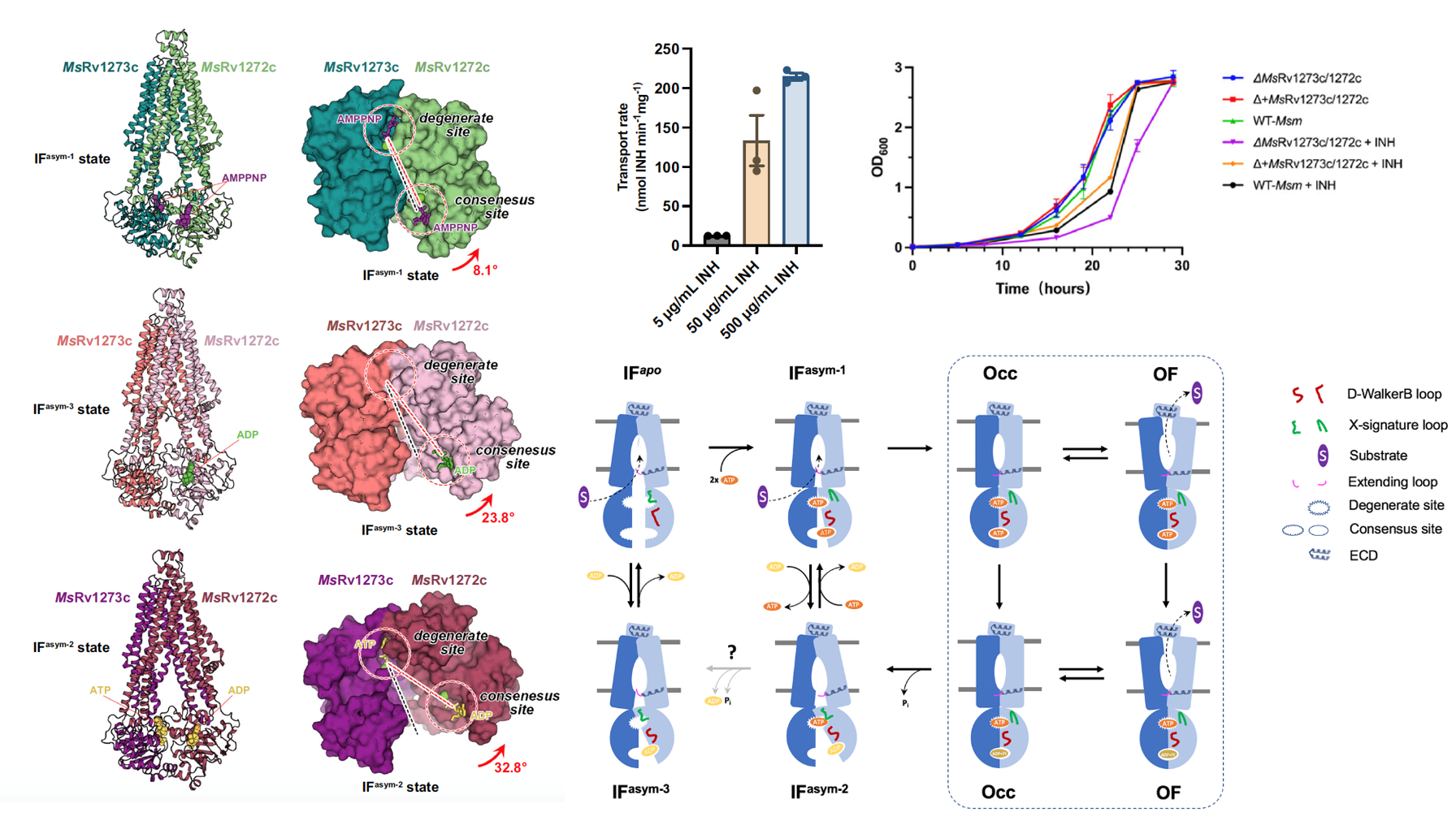
图注:分枝杆菌MsRv1273c/72c的三种不对称中间态结构(左)、异烟肼转运实验(中上),敲除/回补-生长实验(右上),和底物转运机制图(右下)
原文链接:https://www.nature.com/articles/s41467-025-59300-5



