干细胞与表观遗传学实验室
Lab of Stem Cells and Epigenetics
研究方向:
发育和疾病中的表观遗传学
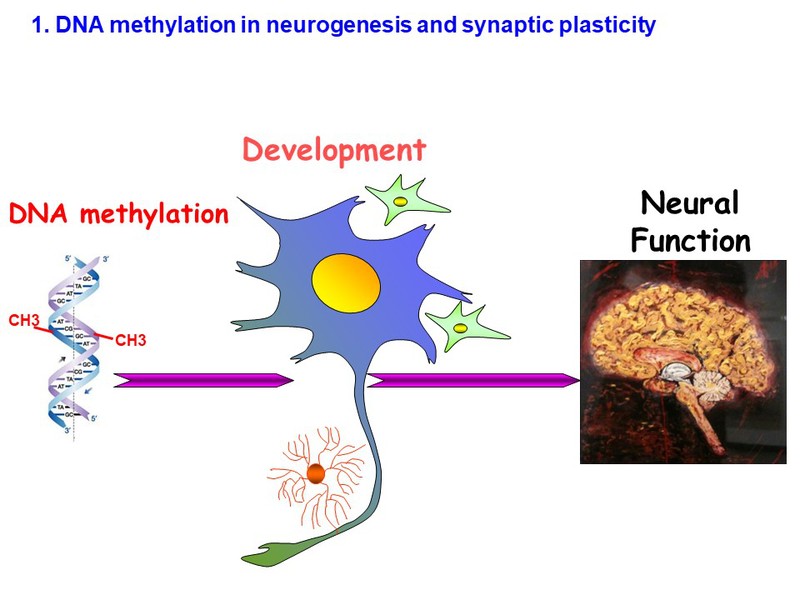
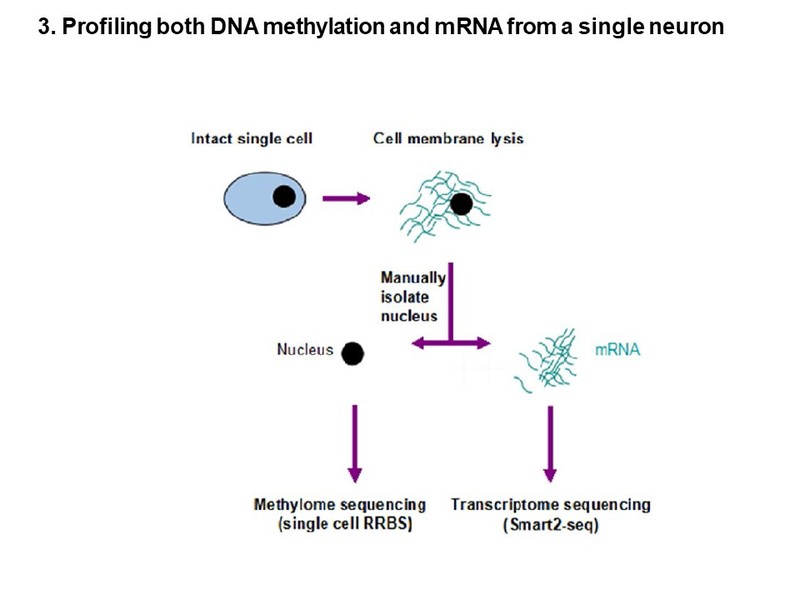
DNA甲基化和组蛋白修饰是参与基因调控和细胞生理学的关键表观遗传因子。DNA甲基化和组蛋白修饰的失调与人类疾病密切有关,包括脆性X,ICF(免疫缺陷,着丝粒不稳定性和面部异常)、过度生长、侏儒症和Rett综合征。为了研究DNA甲基化在发育中的功能,我们使用Cre/loxP系统来特异性地敲除DNA甲基转移酶(Dnmts)。最近,我们应用CRISPR-cas9工具以单核苷酸修饰(gene editing)突变Dnmts,在转基因小鼠中模拟人类疾病基因突变。同时,利用单细胞测序技术,研究Dnmts突变对小鼠大脑发育过程不同时间点、不同等脑区、不同神经元单细胞转录组和单细胞水平染色质可及性数据,解析DNA甲基化改变神经元基因表达,细胞存活和神经元功能的分子机制。
干细胞和转化医学
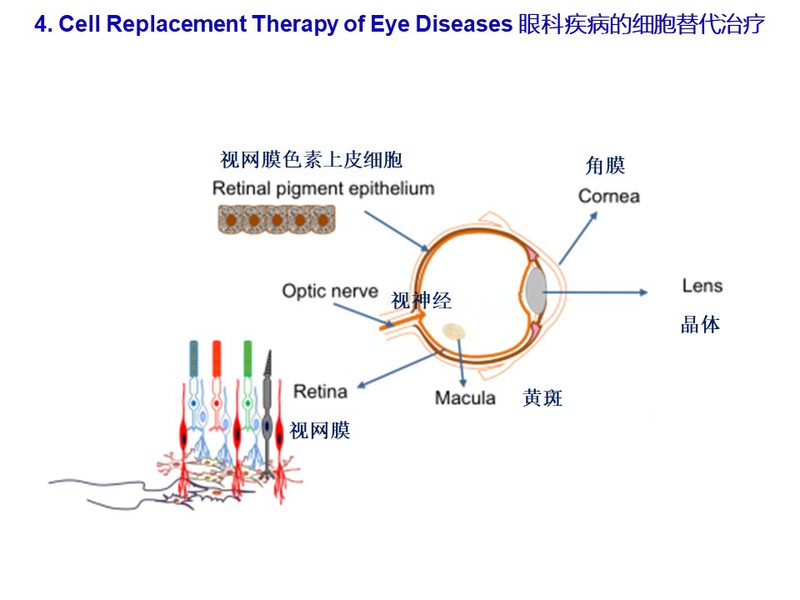
干细胞分化和重编程研究的突破为我们提供了在干细胞中模拟人类遗传疾病的独特机会。我们实验室的重点之一是建立携带基因突变的人类iPSC,这些基因突变导致人类疾病,例如由DNMT3A和DNMT3B点突变引起的过度生长,侏儒症和ICF综合症。这些人类疾病特异性iPSC将用于剖析人类疾病的分子和表观遗传机制。我们还通过3D-类器官的定向分化研究干细胞向特定细胞谱系的分化,包括视网膜色素上皮细胞,角膜内皮细胞,视网膜神经节细胞。通过在视网膜变性动物模型中进行细胞移植研究,我们将试验细胞移植视网膜和角膜的方法,在动物模型验证视力拯救的功效。我们的最终目标是将我们的细胞移植方法转化为治疗患有致盲疾病的人类患者,例如年龄相关性黄斑变性和视网膜色素变性。
开发先进生物材料,体外构建癌症类器官,用于癌症研究
在过去几十年中,传统的二维平面细胞培养技术和鼠类动物模型一直是针对抗肿瘤药物开发最常用的技术手段。然而这些手段缺乏模拟人体组织天然微环境的能力,利用其开发出的药物常常无法通过临床试验的最终考验。因此,在体外开发三维模型以模拟复杂的肿瘤组织微环境,并应用于癌症治病机理的研究和抗癌药物研发已成为生物医学领域的科研热点之一。我们致力于开发新型生物材料和三维细胞培养体系,用于干细胞再生医学以及针对癌症治疗的研究。在前期工作中,我们已开发出多种基于高分子聚合物和生物大分子的多功能性生物材料和可注射水凝胶体系,用于干细胞治疗和肿瘤细胞的培养;利用双光子3D打印技术,我们实现在细胞培养凝胶中构建微米级精细结构,动态研究细胞与细胞、细胞与胞外基质间的相互作用,进而探索肿瘤迁移发展的生物学机理;结合微流控加工技术,开发新型的类器官芯片用于抗癌药物的研发。
Research Projects